Dekstrose potet, tilberedning og bruk
- 3547
- 696
- Anders Mathisen
Han Dextrose Potato Agar Det er et solid, ikke -selektivt ernæringskulturmedium. I den kan bakterie- og sopparter vokse, men bruken er spesielt indikert for isolering av filamentøse sopp og gjær. Det er også kjent som PDA -medium av uttrykket i engelsk potetdextrose agar.
Det er spesielt nyttig for isolering av fytopatogene sopp, det vil si de som påvirker grønnsaker. For å så prøvene fra infiserte grønnsaker, andre medier som sabouraud eller maltagar kan brukes, men for den rutinemessige bruken.
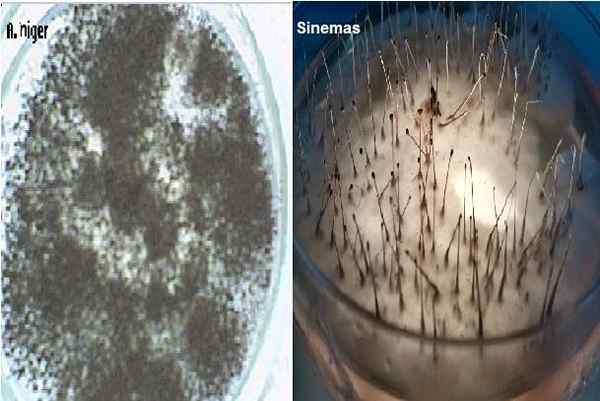
 Aspergillus Niger og Sinemas i Dextrose Pope Agar. Kilde: Alextrevelian 006 på engelsk Wikipedia [Public Domain]/Joselrojas [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Aspergillus Niger og Sinemas i Dextrose Pope Agar. Kilde: Alextrevelian 006 på engelsk Wikipedia [Public Domain]/Joselrojas [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Det brukes også til telling av soppkolonier i prøver av kosmetikk, farmasøytiske produkter og litt meierimat. Det bidrar også til å så hudskrapprøver på jakt etter dermatofytter, som vokser veldig bra i dette mediet, og utvikler sine karakteristiske pigmenter.
Middels dekstrosepave er et veldig enkelt og enkelt medium å tilberede i laboratoriet. Det inneholder, som navnet tilsier, potetinfusjon, dekstrose og agar -agar. I tillegg kan hemmende stoffer tilsettes for å unngå bakteriell vekst og øke selektiviteten for sopparter.
[TOC]
Basis
Dextrose Pope Agar er et kulturmedium som gir de nødvendige ernæringselementene for utvikling av filamentøse sopp og gjær.
Kombinasjonen av potetinfusjon med glukose gir den perfekte energikilden slik at det er en tilfredsstillende vekst av sopp. Mens agar er den som gir konsistens til miljøet.
Mediet alene hemmer ikke veksten av bakterier, derfor er det et ikke -selektivt medium. For å gjøre det selektive behov, aggregat av hemmende stoffer som tartarsyre eller antibiotika.
Forberedelse
-Hjemmelaget (ikke -kommersiell) papa dekstrose agar
Petri -plater
Det er forberedt som følger:
For det første vaskes potetene veldig godt ved å fjerne landet de har. De kuttes i fine skiver med alt og skall. 200 gr av poteter veies og koker i en liter destillert vann, i en halv time.
Tiden er ferdige filtre eller belastning hele preparatet gjennom gasbind.
Den oppnådde væsken er fullført med destillert vann til den når en liter. Infusjonen tilsettes 20 gr agar -agar og 20 gr dextrose, blandes godt og autoklava ved 121 ° C, 15 kilo trykk i 15 minutter.
Kan tjene deg: coevolutionLa avkjøle opp til 50 ° C og server i petrisk sterile plater. De tilberedte platene holdes i kjøleskap.
Kiler
Du kan også tilberede dekstrose potetkiler.
I dette tilfellet, før sterilisering i autoklaven. Spar i et kjøleskap.
Mediet er på en pH på 5.6 ± 0.2 Imidlertid tilfører noen laboratorier 10% tartarsyre for å senke pH til 3,1 ± 0.1 med det formål å hemme bakterievekst.
I samme forstand foretrekker andre laboratorier å legge til antibiotika for å gjøre det selektivt for dyrking av sopp og unngå bakteriell utvikling.
-Kommersiell forberedelse av dekstrose pave agar
Vei 39 gr kommersielt tilgjengelig dehydrert og oppløs i en liter destillert vann. La være i 5 minutter.
Blandingen varmes opp ved å røre ofte til den totale oppløsningen. Deretter steriliseres den i autoklav ved 121 ° C i 15 minutter.
Du kan tilberede tallerkener eller kiler. Fortsett som beskrevet ovenfor.
PH er 5,6 ± 0,2. Hvis pH på 3,1 er ønsket, bør 14 ml sterarisk tartarsyre tilsettes til 20% før servering i platene.
Fargen på det uforberedte mediet er beige og tilberedt er klar rav med et litt skyet eller opalescerende utseende.
applikasjoner
Prosess for å plante planteprøver i dextrose potte
-For blader med flekker
Bladene er kuttet i stykker.
I et kar på 50 cc med 50% alkohol, plasser du bitene av bladene (beisede og sunne biter), for å desinfisere overflaten med 20 til 30 sekunder. Kast alkohol og tilsett natriumhypokloritt 20% i 40 til 50 sekunder hvis de er fine blader og øker tiden til 80 sekunder hvis det er bark og bagasjerom.
Kast natriumhypokloritten og ta de desinfiserte bitene med en steril klemme og legg dem på middels overflate (maksimalt 10 stykker). Plasser datoen og inkuberen fra 20 til 30 ° C.
-For frukt og knoller
Hvis frukten er kjøttfull, må du åpne frukten som er påvirket av soppen og ta stykker med en steril skalpell, både av syke og sunne del og legg den på overflaten av agaren.
Hvis frukten er sitrus, for eksempel en sitron eller en appelsin, må frøene åpnes og så.
Kan tjene deg: fosfatidylinositol: struktur, trening, funksjonerNår fruktoverflaten påvirkes og sporing blir observert, er idealet å bruke den revne metoden på platen; Dette består av å spille Sporous med en sterilisert og avkjølt “L” -formet slikkepott, og deretter sådd i sikksakk 2 til 3 ganger på agaren.
-For korn
De desinfiserer det samme som beskrevet i bladene og deretter plassert på agaren.
-For grener og stilker
Det blir utført en raspekom.
Plakettene som er plantet blir inkubert i aerobiose ved 20-30 ° C i 72 timer.
Prosess for å plante hudskalaer, hår eller negler på dekstrose pave agar
Prøven skal utføres ved hjelp av et skalpelark nr. 11, enten for å kutte berørt hår, hud eller neglesskalaer på jakt etter dermatofytter. Før du tar prøven, må området med 70% alkohol desinfiseres.
-Hudprøve
I svindelen må lesjonene av skaden skrapes, fordi det er mer sannsynlig å finne soppen.
I ekssudative lesjoner er prøven tatt med tørr eller våt vattpinne. Så umiddelbart over paven Dextrose eller Sabouraud Agar. Unngå transportmidler.
En annen prøve som tar metode er gjennom teknikken til Mariat og Ada Campos teppetorg. I dette tilfellet blir det berørte området gnidd 5 ganger med et stykke steril ull for den påfølgende avlingen.
Prøven kan plasseres direkte i kulturmediet.
-Hårprøve
Avhengig av patologien kan den berørte delen eller rotstartene kuttes. Plasser prøven i kulturmediet.
-Prøve av spiker
De kan skrapes eller kutte en bestemt del av den berørte neglen. Vil avhenge av typen skader.
Skjær prøven i biter på 1 mm før såing for å øke sannsynligheten for soppkontakt med kulturmediet.
Identifikasjonsprosedyre
Koloniene oppnådd i platen er isolert i rør inneholder.
Den mikroskopiske studien (observasjon av strukturer og deres formasjoner), kan gjøres ved mikrokulturer eller direkte observasjon til mikroskopet mellom ark og lamella.
Kan tjene deg: histidin: egenskaper, struktur, funksjoner, matKolonier teller
Dette mediet kan også brukes til å bestemme belastningen av sopp og gjær som er til stede i planteprøver, mat, kosmetikk eller medisiner. For dette formål brukes potetpotet supplert agar med antibiotika, for eksempel: (Chloramphenicol, klorotetracyklin eller begge deler).
Hell 1 ml av prøven - helst fortynnet - på en steril og tom petriskaller. Hell over petriskallen og roter til homogeniserer. La være i ro til.
Inkuber i aerobiose ved 20-25 ° C (mugg) eller ved 30-32 ° C (gjær) i 5 til 7 dager eller mer, avhengig av type sopp som søkes og typen prøve. To plater kan brukes til å inkubere begge temperaturområdene.
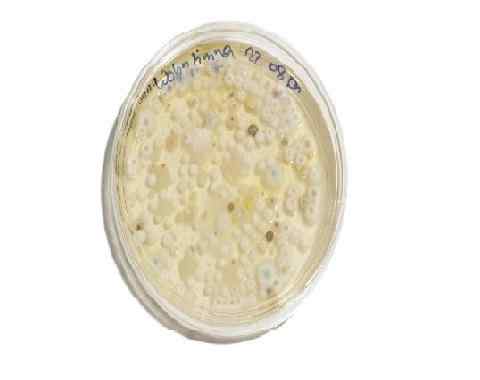 Professor i soppkolonier i en prøve av mat. Dekstrose potetagar supplert med antibiotika. Kilde: Pxhere.com photo/777267
Professor i soppkolonier i en prøve av mat. Dekstrose potetagar supplert med antibiotika. Kilde: Pxhere.com photo/777267 Vedlikehold av soppstammer
Dextrose Pope Agar kan brukes til å opprettholde levedyktige soppstammer i flere år.
For dette dyrkes soppen i dekstrose potetkiler, og når soppen er dyrket, er den dekket med mineralolje. Oljen må steriliseres i autoklav i 45 minutter, og ha en omtrentlig viskositet på 300 til 330 Saybolt. Oljen må overstige 1 til 2 cm spissen av rammen.
QA
Fra hvert forberedt parti må 1 eller 2 plater tas og inkuberes ved 25 ° C i 48 timer eller 20 ° C i 96 timer. God sterilitetskontroll er en der kolonierutvikling ikke blir observert.
Du kan også bruke kjente eller sertifiserte kontroller som:
Saccharomyces cerevisiae ATCC 9763, Candida albicans ATCC 10231, Aspergillus brasiliensis ATCC 16404, Trichophyton mentagrophytes ATCC 9533. I alle tilfeller forventes det god vekst.
Referanser
- Britania Laboratories. Glykosado potte. 2015. Tilgjengelig på: Britanialab.com
- Neogen Laboratories. Dekstrose potet. Tilgjengelig på: Foodsafety.Neogen.com
- Insumolab laboratorium. Dextrose Potato Agar. Tilgjengelig på: Insumolab.Cl
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12 Ed. Pan -American redaksjon S.TIL. Argentina.
- Hushus g. Generell mykologi. 1994. 2. utg. Central University of Venezuela, bibliotekutgaver. Venezuela Caracas.
- Aceituno m. Evaluering av mikrobiologisk kvalitet i øyenskygge, kompakt støvtype av et nasjonalt produksjonslaboratorium, ifølge Pharmacoea USP 2005. Avhandling for å velge tittelen som farmasøytisk kjemiker. University of San Carlos of Guatemala.
- Cuétara m. Behandling av overflateprøver. Ibero -American Mycology Magazine. 2007; pp. 1-12

