Sekundær alkohol hva er, struktur, egenskaper, bruker
- 2464
- 774
- Marius Aasen
Hva er en sekundær alkohol?
EN sekundær alkohol Den har karbonkarbonet i hydroksylgruppen (OH), festet til to karbonatomer. I mellomtiden, i primær alkohol, er karbonkarbonet i hydroksylgruppen knyttet til et karbonatom, og i tertiær alkohol festet til tre karbonatomer.
Alkoholene er litt svakere syrer enn vann, med følgende PKA: vann (15,7); Metylalkoholer (15,2), etyl (16), isopropyl (sekundær alkohol, 17) og termisk (18). Som det kan sees, er isopropylalkohol mindre sur enn metyl- og etylalkoholer.
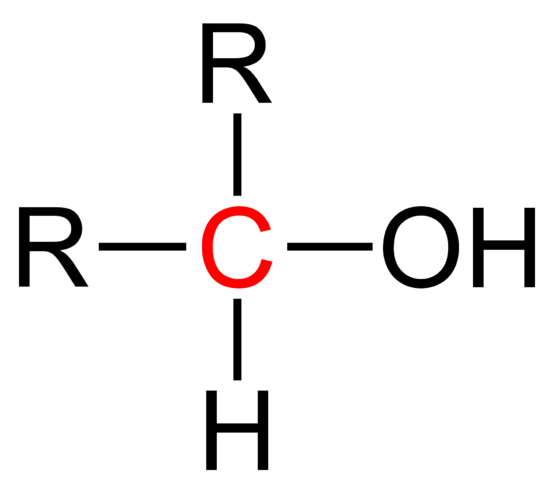
 Strukturformel av en sekundær alkohol. Wikimedia Commons
Strukturformel av en sekundær alkohol. Wikimedia Commons I det øvre bildet vises den strukturelle formelen for en sekundær alkohol. Rødt karbon er bærer av OH, og er knyttet til to alkyl (eller aryl) R -grupper og et enkelt hydrogenatom.
Alle alkoholer har den generiske formelen ROH; Men hvis bærerkarbonet blir observert i detalj, oppnås de primære alkoholer (RCH2Å), sekundær (r2Choh, oppvokst her), og tertiær (r3COH). Dette faktum utgjør en forskjell i dets fysiske egenskaper og reaktivitet.
Struktur av en sekundær alkohol
Alkoholstrukturer avhenger av arten av R -grupper. For sekundære alkoholer kan imidlertid det gjøres noe eksemplifisering, med tanke på at det bare kan være lineære strukturer med eller uten forgreninger, eller sykliske strukturer. For eksempel har du følgende bilde:
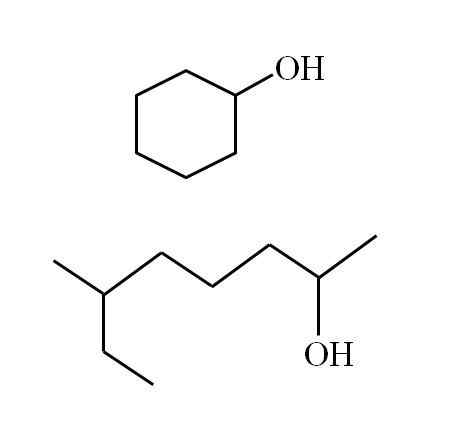 En syklisk sekundær alkohol og en annen forgrenet kjede. Kilde: Gabriel Bolívar
En syklisk sekundær alkohol og en annen forgrenet kjede. Kilde: Gabriel Bolívar Merk at for begge strukturer er det noe til felles: OH er koblet til en "V". Hver ende av V representerer en lik gruppe (øvre del av bildet, syklisk struktur) eller forskjellig (nedre del, forgrenet kjede).
På denne måten blir enhver sekundær alkohol veldig lett identifisert, selv om nomenklaturen i det hele tatt er ukjent.
Egenskaper
Kokende poeng
Egenskapene til sekundære alkoholer skiller seg ikke for mye fra andre alkoholer. De er vanligvis gjennomsiktige væsker, og for å være et fast stoff ved romtemperatur, må det danne flere hydrogenbroer og ha høy molekylmasse.
Det kan tjene deg: perbromsyre (HBRO4): Egenskaper, risikoer og bruksområderImidlertid den samme strukturelle formelen r2Choh foreslår visse unike egenskaper generelt for disse alkoholene. For eksempel er OH -gruppen mindre utsatt og tilgjengelig for interaksjoner med hydrogenbroer, r2Ch-oh-ohchr2.
Dette er fordi R -gruppene, ved siden av karbonkarbonet, kan bringes og hindrer dannelsen av hydrogenbroer. Som et resultat har sekundære alkoholer lavere kokepunkter enn primær (RCH2ÅH).
Surhet
I følge Brönsted-Lowrys definisjon er en syre en som donerer protoner eller hydrogenioner, h+. Når dette skjer med en sekundær alkohol, har du:
R2Choh + b- => R2Cho- + Hb
Konjugatet Ras2Cho-, Alcoxide Anion, din negative belastning må stabilisere seg. For sekundær alkohol er stabiliseringen lavere siden de to R -gruppene har elektronisk tetthet, som frastøter den negative belastningen på oksygenatomet i en viss grad.
I mellomtiden, for alkoksydanionen til en primær alkohol, RCH2ENTEN-, Det er mindre elektronisk frastøtning som bare har en R -gruppe og ikke to. I tillegg utøver hydrogenatomer ikke betydelig frastøtning, og tvert imot bidrar de til å stabilisere den negative belastningen.
Derfor er sekundære alkoholer mindre sure enn primære alkoholer. Hvis dette er slik, er de mer grunnleggende, og nettopp av samme grunner:
R2Choh + h2B+ => R2Choh2+ + Hb
Nå stabiliserer R -gruppene den positive belastningen i oksygen ved å gi en del av deres elektroniske tetthet.
Reaksjoner
Hydrogenhallogenid og fosfor -trihalogenid
En sekundær alkohol kan reagere med et hydrogenhalogenid. Den kjemiske ligningen av reaksjonen mellom isopropylalkohol og bromhytinsyre er vist på et middel for svovelsyre, og produserer isopropylbromid:
Ch3Chohch3 + HBR => CH3Chbrch3 + H2ENTEN
Og du kan også reagere med en trihalogenuero av fosfor, PX3 (X = br, i):
Det kan tjene deg: Nikkelhydroksid (III): Struktur, egenskaper, bruksområder, risikoCh3-Choh-ch2-Ch2-Ch3 + PBR3 => CH3-CHBR-CH2-Ch2-Ch3 + H3Po3
Kjemikaliet ovenfor tilsvarer reaksjonen mellom seksjonen og fosfor-tribromidet, noe som forårsaker Sec-pentil bromid.
Merk at i begge reaksjoner er det et sekundært alkylhalogenid (r2CHX).
Dehydrering
I denne reaksjonen går en H og en OH av nærliggende karbonatomer tapt, og danner en dobbeltbinding mellom disse to karbonatomene. Derfor er det dannelsen av en alken. Reaksjonen krever en syrekatalysator og varmeforsyning.
Alkohol => Alken + H2ENTEN
Du har for eksempel følgende reaksjon:
Cyclohexanol => cyclohexen + h2ENTEN
Reaksjon med aktive metaller
Sekundære alkoholer kan reagere med metaller:
Ch3-Choh-ch3 + K => cho3Cho-K+Ch3 + ½ h+
Her reagerer isopropylalkohol med kalium for å danne kaliumisoproksyd og hydrogenioner.
Forestring
Sekundær alkohol reagerer med en karboksylsyre for å stamme en ester. For eksempel vises den kjemiske ligningen av reaksjonen av sechutil alkohol med eddiksyre, for å produsere semi-butylacetat:
Ch3Chohch2Ch3 + Ch3COOH CH3Coochch3Ch2Ch3
Oksidasjon
Primære alkoholer oksiderer aldehydos, og disse oksiderer igjen karboksylsyrer. Men sekundære alkoholer oksiderer aceton. Reaksjonene blir vanligvis katalysert av kaliumdikromat (k2Cro7) og kromsyre (h2Cro4).
Den globale reaksjonen er:
R2Choh => r2C = O
Nomenklatur
Sekundære alkoholer utnevnes ved å peke på OH -gruppens plassering i hovedkjeden (lenger). Dette nummeret går foran navnet, eller kan følge navnet på den respektive alkanen for nevnte kjede.
For eksempel Cho3Ch2Ch2Ch2Chohch3, Det er 2-heksanol eller heksan-2-til.
Hvis strukturen er syklisk, er det ikke nødvendig å plassere en teller; Med mindre det er andre substituenter. Det er grunnen til at den sykliske alkoholen til det andre bildet kalles Cyclohexanol (ringen er sekskantet).
Kan tjene deg: aminerOg for den andre alkoholen med det samme bildet (det forgrenede) er navnet: 6-etyl-heptan-2 -ol.
applikasjoner
-SEC-Butanol brukes som et løsningsmiddel og mellomliggende kjemikalie. Det er til stede i de hydrauliske væskene for bremser, industrielle rengjøringsmidler, polering, pinting, mineralflotasjonsmidler og frukt og parfyme -essenser.
-Isopropanolalkohol brukes som et industrielt løsemiddel og som antikoagulant. Det brukes i oljer og hurtigtørking av blekk, for eksempel antiseptisk middel og erstatning for kosmetikk etanol (for eksempel: hudkremer, kapillær tonic og friksjonalkohol).
-Isopropanol er en ingrediens i flytende såper, krystallrensere, syntetiske aromatizere av ikke -alkoholholdige drikker og mat. I tillegg er det et mellomliggende kjemikalie.
-Cyclohexanol brukes som et løsningsmiddel, i vevsfinishen, i behandlingen av lær og emulgerende såper, og syntetiske vaskemidler.
-Metylciclohexanol er en ingrediens i tyggingsprodukter basert på såpe og vaskemidler for spesielle vev.
Eksempler
2-oktanol
 2-oRTANOL MOLECYLE. Kilde: Jü [Public Domain], fra Wikimedia Commons
2-oRTANOL MOLECYLE. Kilde: Jü [Public Domain], fra Wikimedia Commons Det er en fet alkohol. Det er en fargeløs væske, lite oppløselig i vann, men løselig i de fleste ikke -polare løsningsmidler. Den brukes blant annet i utdyping av smaker og dufter, malerier og belegg, blekk, lim, husholdningsomsorg og smøremidler.
Estradiol eller 17β-Stradiol
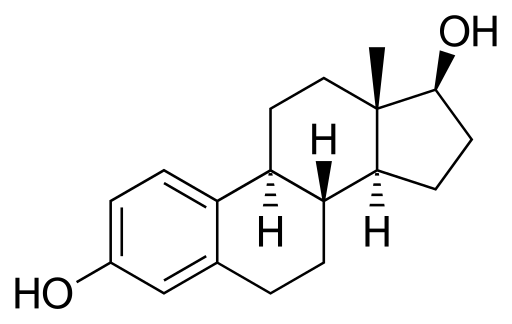 Østradiolmolekyl. Kilde: Neurotoger [Public Domain], fra Wikimedia Commons
Østradiolmolekyl. Kilde: Neurotoger [Public Domain], fra Wikimedia Commons Det er et steroid seksuelt hormon. Den har to hydroksiljegrupper i sin struktur. Det er det dominerende østrogenet i løpet av reproduksjonsårene.
20-hydroksy-leukotrien
Det er en metabolitt som sannsynligvis stammer fra oksidasjon av leukotrien lipid. Det er klassifisert som en leukotrien cystinyl. Disse forbindelsene er formidlere av den inflammatoriske prosessen som bidrar til de patofysiologiske egenskapene til allergisk rhinitt.
2-heptanol
Det er en alkohol som finnes i frukt. I tillegg finnes det i ingefærolje og jordbær. Det er gjennomsiktig, fargeløs og uoppløselig i vann. Det brukes som et løsningsmiddel av flere harpikser og griper inn i flotasjonsfasen i mineralbehandling.
Referanser
- Encyclopedia of Health and Safety på jobb. (s.F.). Alkoholer. [PDF]. Gjenopprettet fra: Insht.er
- Struktur og klassifisering av alkoholer. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org

