Karbon alotropes
- 3558
- 325
- Marius Aasen
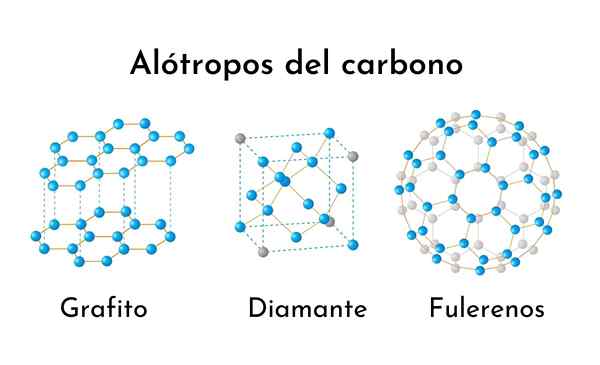
 Tre av de vanligste karbonalotropene
Tre av de vanligste karbonalotropene Hva er karbonalotroper?
Det alotropiske ordet refererer til de forskjellige molekylære formene der et kjemisk element kan presenteres. Derfor er karbonalotroper alle former, naturlige eller ikke, da det rene karbonelementet kan presenteres.
Til tross for at de har nøyaktig den samme sammensetningen, kan alotroper ha helt andre egenskaper.
Dette er spesielt beryktet når det gjelder karbonalotroper. Som vi vil se senere, danner en av alotropene, diamanten, perfekt gjennomsiktige og utrolig harde krystaller, mens andre er myke og sprø stoffer.
Deretter beskrives alle karbon -alotrops så langt, sammen med deres mest fremragende egenskaper og deres applikasjoner:
Diamant
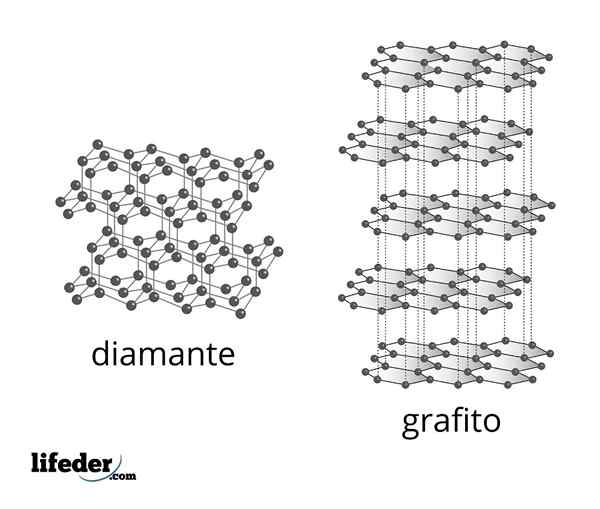 Mikroskopisk struktur av diamant og grafitt
Mikroskopisk struktur av diamant og grafitt Diamanten er den mest stabile formen for karbon og er en av de to mest kjente alotropene av det elementet. Det er sammensatt av tetraedrale karbonatomer med SP -hybridisering3 koblet ved hjelp av enkle C-C kovalente bindinger i et tredimensjonalt kovalent nettverk.
Denne karbon -alotropen er naturlig eller kan produseres industrielt fra grafitt med høyt trykk.
Egenskaper
- Den består av et gjennomsiktig og fargeløst krystallinsk fast stoff som kan poleres med høy lysstyrke.
- Det er det vanskeligste mineralet kjent av mennesket. Dette betyr at en diamant er i stand til å skrape overflaten til noe annet materiale og bare kan riper med en annen diamant.
- Det er et av de dyreste naturlige elementene i verden.
- Det er den beste termiske lederen som er kjent, med en termisk ledningsevne mellom 1300 og 2300 w/m.K.
- Utfører ikke strøm.
- Den har en veldig lav termisk ekspansjonskoeffisient.
- Den har en veldig lav friksjonskoeffisient.
applikasjoner
- Den mest kjente daglige bruken er i smykker.
- På grunn av hardheten er det et utmerket slipende materiale, så det tilsettes overflaten av skjære- og poleringsinstrumenter av metaller, bergarter, etc.
- På grunn av dets termiske egenskaper brukes den i fremstilling av varmedissipatorer.
- Det brukes i fremstilling av mikrolagre med lav friksjon.
Grafitt
Det er en av de mest kjente karbonalotropene. Det er et veldig vanlig materiale som har en struktur dannet av ark med karbonatomer stablet oppå den andre.
Alle karbonatomer i grafitt har SP -hybridisering2, Så de har en flat trigonal struktur. Hvert karbon er knyttet til tre andre nabokarboner som danner sekskanter som ligner på benzen, med et elektronsystem PI Democated på overflaten av hvert ark, som får grafitt til å dirigere elektrisitet.
Egenskaper
- Det er et solid svart materiale ved romtemperatur.
- Det er drivstoff, slik at du kan brenne i nærvær av oksygen.
- Grafitt er en god elektrisk leder.
- Den har et høyt smeltepunkt.
- Det er et mykt materiale som gir inntrykk av å være glatt.
- Den har en lav friksjonskoeffisient.
- Det er en god termisk leder.
applikasjoner
- Det brukes ofte i fremstilling av blyanter for å skrive eller for tegning.
- Det brukes ofte som et tørt smøremiddel.
- På grunn av dens elektriske ledningsevne og lave kjemiske reaktiviteter, brukes den ofte i elektriske kontakter i forskjellige elektroniske enheter.
- Det brukes i elektroder for kjemisk analyse.
Grafen
 Grafenstruktur
Grafenstruktur Grafen er ikke annet enn et ark isolert grafitt. Det er definert som en to -dimensjonal krystall, og den oppnås ved å skille grafittlagene med limtape. Graphene har unike egenskaper som skiller det fra grafitt, til tross for at de ligner mye i strukturen.
Kan tjene deg: Beer-Lambe LawEgenskaper
- Høy elektrisk og termisk ledningsevne.
- Det er et elastisk og fleksibelt materiale, men samtidig med høy hardhet og motstand.
- For å ha en enkelt karbonatomtykkelse, er det et helt gjennomsiktig materiale.
- Det kan generere strøm ved eksponering for sollys.
applikasjoner
- Fleksible skjermer.
- Fleksible elektroniske kretsløp.
- Antikorrosive belegg.
- Veldig effektive solcellepaneler.
- DNA -sekvenseringssystemer.
- Biosensorer med høy presisjon.
Gutter eller nanokarbon
Gutta er lukkede molekylære strukturer som bare er dannet av karbonatomer der arrangementer presenteres i form av ringer på 4 til 7 medlemmer.
Avhengig av størrelse og form, blir flere typer gutter vanligvis utmerket:
Buckminsterfulerane (ca60)
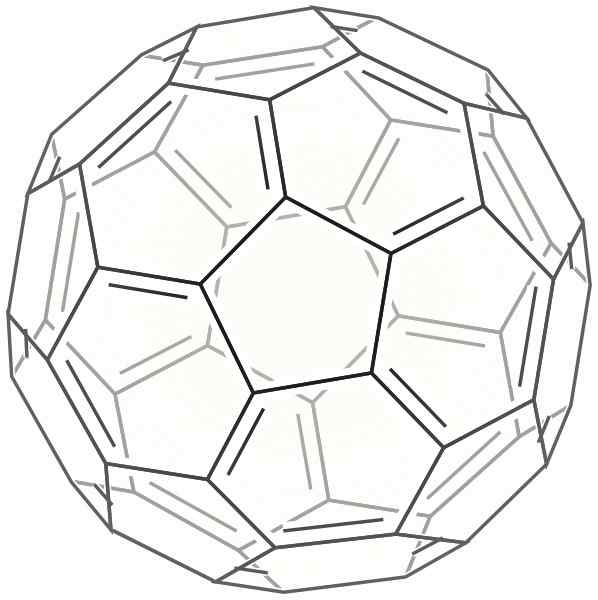 2d Buckminsterfulera Skeleton
2d Buckminsterfulera Skeleton Dette er formet som en sfære som er veldig lik en fotball. Det kalles også Bucky Ball.
Egenskaper
- Høy elektrisk og termisk ledningsevne
- Motstand med høy spenning.
- De danner et veldig duktilt materiale.
- De er relativt inerte til kjemiske reaksjoner.
applikasjoner
- Antiviraler
- Antioksidanter
- Medikamentadministrasjonssystemer
Karbon nanorør
 Struktur av en karbon nanotubus der alle karbonatomer er forent sammen ved hjelp av ikke -polare kovalente bindinger
Struktur av en karbon nanotubus der alle karbonatomer er forent sammen ved hjelp av ikke -polare kovalente bindinger Disse danner basen og begynnelsen av nanoteknologi. De er lange slag med rørformet form og er et av de mest studerte materialene i dag av de utallige anvendelsene av deres unike egenskaper.
Egenskaper
De har de samme grunnleggende egenskapene til Bucky Balls, men når de er langstrakte, er de bedre elektrisitetsførere i aksial retning.
applikasjoner
- I fremstilling av nanokomponerte materialer med unike mekaniske, termiske og elektriske egenskaper.
- Molekylære elektronikksystemer.
- Biosensorer med høy følsomhet.
- Energilagringssystemer.
Grafenylen
Denne alotropiske har en to -dimensjonal glassstruktur som er veldig lik grafen, men dannet av bifenilenenheter med ringer på fire medlemmer ispedd mellom ringene på seks, i stedet for bare å inneholde sekskantede ordninger.
Grafitt aa '
Dette er en karbonform oppdaget i 2008. Det er en spesiell type grafitt som bare skiller seg ut i måten grafittarkene er stablet på toppen av den andre. Det er en metastabil grafittform som kan forklare dannelsen og egenskapene til noen karbon nanorør i flere lag.
Grafenylen
Graphenylen er en ny nylig oppdaget karbonotropisk. De består av en to -dimensjonal diamantform som oppnås ved å komprimere grafitt ved veldig høyt trykk. Dette fører til at grafittark kobles til hverandre, og danner en diamant med bare noen få tykke karbonatomer.
Amorft karbon
Det består vanligvis av en blanding av forskjellige former for karbon i forskjellige proporsjoner. Nanorør kan inneholde eller andre typer gutter, grafitt osv. Det finnes i naturlige prøver som mineral eller trekull forårsaket av trepyrolyse.
Det brukes hovedsakelig som drivstoff i oppvarming, energiproduksjon eller matlaging.
Vitratisk karbon
Det er en karbonform oppnådd ved å varme opp noen organiske forløpere ved høye temperaturer. Det er et veldig resistent materiale ved høye temperaturer og kjemisk angrep av syre og oksygen. Det er også ugjennomtrengelig for gasser.

