Kinetisk enzym
- 5098
- 1395
- Jonathan Moe
Hva er enzymatisk kinetikk?
De Kinetisk enzym Det er et studiefelt der fysikjemi og biokjemi møtes for å studere kjemiske reaksjoner katalysert av enzymer. Enzymer er biologiske katalysatorer som øker hastigheten på en kjemisk reaksjon ved å redusere aktiveringsenergien.
Enzymer katalyserer kjemiske reaksjoner av stor betydning for å opprettholde livet. De har både en pH og en optimal temperatur for å utøve sin katalytiske virkning på underlaget, så de er essensielle faktorer i studiet av sine aktiviteter.
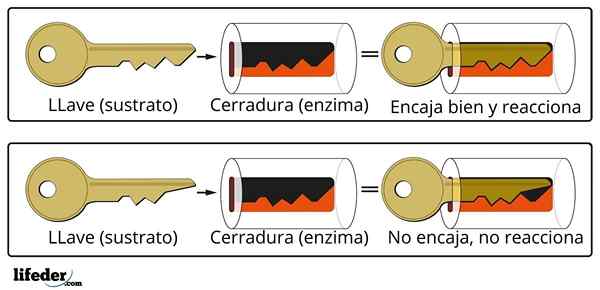
 Det nøkkellysingssystemet er en omtrentlig analogi med substrat-enzymsystemet.
Det nøkkellysingssystemet er en omtrentlig analogi med substrat-enzymsystemet. Enzymet interagerer med underlaget gjennom et spesialisert område av proteinkjeden, som kalles et aktivt senter, hvis tre -dimensjonale struktur er koblet til underlagsstrukturen. Samspillet mellom det aktive senteret og underlaget er vanligvis svakt og ikke kovalent.
Antall aktive enzymsentre er begrenset, og produserer metningen med substratmolekyler, som igjen forhindrer hastigheten på reaksjonen fra å øke utover en viss verdi, kjent som maksimal hastighet.
Enzymatisk kinetikk kombinerer ikke bare biokjemi og fysikjemi, men også bioinorganisk, supramolekylær kjemi, beregningskjemi og statistikk.
Blant modellene som beskriver det er Michaelis -Menc. I dag er det fortsatt en av modellene som brukes mest til å beskrive den enzymatiske kinetikken.
Grunnleggende konsepter i enzymatisk kinetikk
Enzymatisk katalyse
Enzymer er proteiner, med katalytiske aktiviteter, i stand til å virke på et molekyl kalt underlag, og katalyserer transformasjonen til et annet stoff kjent som produkt. Enzymer forbrukes ikke under deres katalytiske virkning, og forblir sin konstante masse.
Katalytisk aktivitet
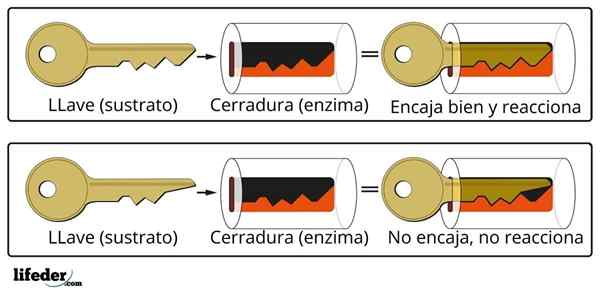
Den katalytiske aktiviteten til enzymet utføres i en spesialisert tredimensjonal struktur kjent som det aktive senteret. Dette dannes av folden til den enzymatiske proteinkjeden som bestemmer interaksjonen mellom en gruppe aminosyrer som danner det aktive senteret.
Aktivt senter
Det aktive senteret er ikke en stiv struktur, men i stand til geometrisk tilpasning til underlaget for å samhandle med det. Interaksjonen er generelt svak (van der Waals -krefter), selv om det er enzymer som danner en kovalent kobling med underlaget.
Kan tjene deg: Butyric Fat: Innhenting, typer, sammensetning, bruksområder, fordelerRedusert aktiveringsenergi
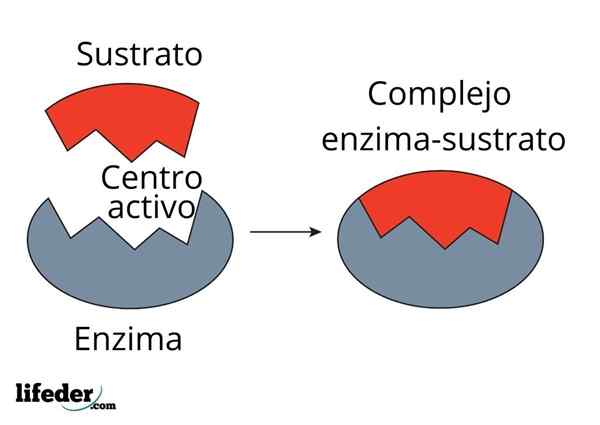
 Karbonanhydraseenzym reduserer aktiveringsenergi for CO2 til H2CO3 -konvertering. Kilde: Fvasconcellos (snakk • bidrag), CC BY-SA 3.0, via Wikimedia Commons
Karbonanhydraseenzym reduserer aktiveringsenergi for CO2 til H2CO3 -konvertering. Kilde: Fvasconcellos (snakk • bidrag), CC BY-SA 3.0, via Wikimedia Commons Enzymer katalyserer reaksjoner avtar aktiveringsenergi, og reduserer derfor også fritt energiforbruk (g) som er nødvendig for fullføring av den katalyserte prosessen. Enzymer modifiserer ikke likevektspunktet for ikke -katalyserte kjemiske reaksjoner.
Merk hvordan karbonanhydraseenzym reduserer aktiveringsenergi for co -konvertering2 til h2Co3. Selv om avstanden mellom den røde og den blålige linjen ikke virker mye, øker dette enzymet hastigheten i størrelsesorden millioner av ganger (106), sammenlignet med reaksjonen utført uten deres deltakelse.
Stereoespecificity
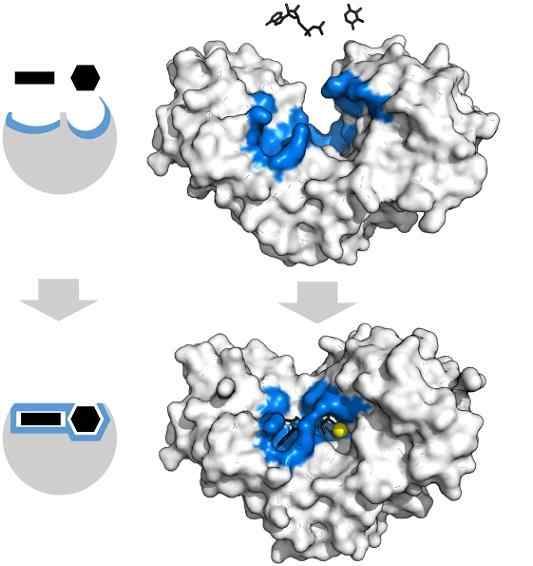 Adenosinsubstrater Tryfosfat og xylose har den spesifikke formen som sammenfaller med geometrien til det aktive sentrum av heksokinaseenzymet. Kilde: Thomas Shafee, CC av 4.0, via Wikimedia Commons
Adenosinsubstrater Tryfosfat og xylose har den spesifikke formen som sammenfaller med geometrien til det aktive sentrum av heksokinaseenzymet. Kilde: Thomas Shafee, CC av 4.0, via Wikimedia Commons Enzymer er generelt svært spesifikke for reaksjonene de katalyserer, siden underlagsmolekylene må samhandle med det aktive senteret som presenterer et sett med krav til koblingen deres med det.
For eksempel tilbyr det aktive senteret for heksokinase, som er dynamisk på grunn av molekylære vibrasjoner av proteinkjeder, grupper i eksakte romlige orienteringer slik at adenosin og xylose adenosinmolekyler, kalk opp som om de var brikker som fylte geometriske.
Den minste fysiske eller kjemiske forstyrrelsen, og det blå -heksokinaseområdet har ikke lenger plass til underlagene.
Topphastighet
Enzymer har et begrenset antall aktive sentre, så ved å øke underlagskonsentrasjonen. Dette bestemmer at hastigheten på den katalyserte reaksjonen ikke kan øke utover en viss verdi, kjent som maksimal hastighet.
Temperaturfølsomhet og pH
Enzymatisk katalytisk aktivitet er avhengig av temperatur og pH, med optimale verdier av disse parametrene for dens drift. På samme måte, fordi det er enzymene proteinmolekyler, er de mottagelige for en kjemisk eller termisk denaturering.
Kofaktorer
Noen enzymer øker sin katalytiske aktivitet på grunn av påvirkning av visse faktorer, som kan være metaller eller organiske forbindelser kjent som koenzymer.
På samme måte kan enzymer hemmes konkurransedyktig og ikke -konkurransedy. Når det gjelder heksokinasen ovenfra, MG2+ (gul sfære) fungerer som en kofaktor.
Enzymatisk reaksjonshastighet
Hastigheten på en enzymatisk reaksjon avhenger av konsentrasjonen av underlag og enzymatisk konsentrasjon. Når underlagskonsentrasjonen er lav, er det en nesten lineær sammenheng mellom enzymatisk hastighet og underlagskonsentrasjon.
Det kan tjene deg: Ingen metaller: Historie, egenskaper, grupper, bruksområderDerfor øker enzymatisk hastighet i direkte andel til underlagskonsentrasjon; Men ved å øke konsentrasjonen av underlag til en verdi som metter de aktive setene til enzymet, er maksimal hastighet nådd.
Når den enzymatiske hastigheten oppstår, blir den konstant, det vil si at den er uavhengig av underlagskonsentrasjonen, og det sies at enzymatisk hastighet er null. I tillegg er katalytisk enzymatisk hastighet proporsjonal med konsentrasjonen av enzym-substratkomplekset [IS].
Som det matematiske uttrykket viser:
V = k2[ER]
Maksimal hastighet er direkte proporsjonal med den totale konsentrasjonen av enzymet, slik det vises i følgende formel:
VMaks = KKattOGt
KKatt Det er rotasjons- eller erstatningsnummeret og representerer antall underlagsmolekyler som hvert enzymatisk sted konverterer til et produkt per tidsenhet. Samtidig somt representerer antall katalytiske enzymatiske steder. Jat Det har en høy verdi, en høyere [S] er påkrevd for å mette de aktive stedene eller sentrene.
Michaelis -mente ligning
Modell
Mihaelis -mente -modellen er basert på virkningen av enzymer som virker på et enkelt underlag og er ikke anvendelig for de alosteriske enzymer; Det vil si de som har en regulatorisk region for den katalytiske aktiviteten til det aktive stedet.
Enzymer ved en lav konsentrasjon av underlag har en katalytisk aktivitet som er lineær med konsentrasjonen av underlag; Men ved høye underlagskonsentrasjoner er katalytisk aktivitet uavhengig av underlagskonsentrasjon.
I 1913 foreslo Leonor Michelis og Maud Minded en modell for å forklare den enzymatiske oppførselen som ble indikert, eksistensen av et enzymsustratisk mellomliggende kompleks [er] som viktige i modellen [er].
Generell ligning
Forholdet mellom dette komplekset og de andre komponentene i den enzymatiske prosessen, så vel som med konstantene (k) som relaterer dem, er indikert i følgende skjema:
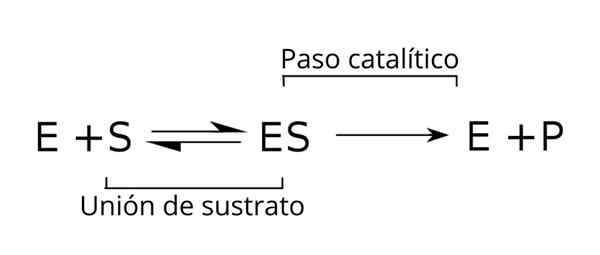 Generell ligning av underlagene, enzym-substratkomplekset og produktene fra enzymatisk kinetikk. Kilde: Tim Vickers via Wikipedia.
Generell ligning av underlagene, enzym-substratkomplekset og produktene fra enzymatisk kinetikk. Kilde: Tim Vickers via Wikipedia. Enzymet (E) er kombinert med underlaget (e) for å danne enzym-substratkomplekset med en K-hastighetskonstant1. E-S-komplekset kan dissosiere i E og S med en reaksjonshastighetskonstant k-1.
På samme måte kan komplekset forårsake et produkt (P) og separasjonen av enzymet, som kan resirkuleres for å oppfylle en annen syklus av enzymatisk aktivitet. En balansesituasjon kan oppnås for staten [er] der dannelseshastigheten er lik dens nedbrytningshastighet.
Det kan tjene deg: naturlige kjemiske elementerK1[Er] [s] = (k-1 + K2) [Er] (1)
Gjengruppering av vilkår og rydding [er], har du:
[Er] = ([e] [s]) / (k-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM Det er en konstant introdusert av Michaelis.
Vilkårene for Michaelis -mente -ligningen
Erstatter nå kM I (2) fortsetter vi:
[Er] = [e] [s] / kM (3)
Konsentrasjonen av ikke -kombinert enzym er:
[E] = [eT] - [es] (4)
Hvor [e] er det frie enzymet og [eT] Den totale konsentrasjonen av enzymet.
Kombinere ligningene 3 og 4, gjør erstatningene på grunn, og tar også hensyn til vMaks, Michaelis-Muene-ligningen nås, uttrykt på følgende måte:
V = (vMaks [S]) / ([s] + kM)
Maksimal hastighet på den enzymatiske reaksjonen oppstår når underlagskonsentrasjonen er mye større enn KM Og de katalytiske stedene til enzymene er mettede med underlag. Dette skjer når forholdet [s]/[s] + kM Tilnærminger til 1.
Når [S] er lik KM, Den delen av ligningen [S] / [S] + KM er lik 1/2, som indikerer at kM Det er konsentrasjonen av underlag som gir en enzymatisk reaksjonshastighet som er halvparten av maksimal hastighet.
I tillegg, kM Det er et mål på affiniteten til et enzym av underlaget: jo større er verdien av kM, mindreårig vil være affiniteten til enzymet for underlaget og omvendt. Derfor til en kM Høy hastigheten på den enzymatiske reaksjonen vil være lav.
Lineweaver-Burk Graph
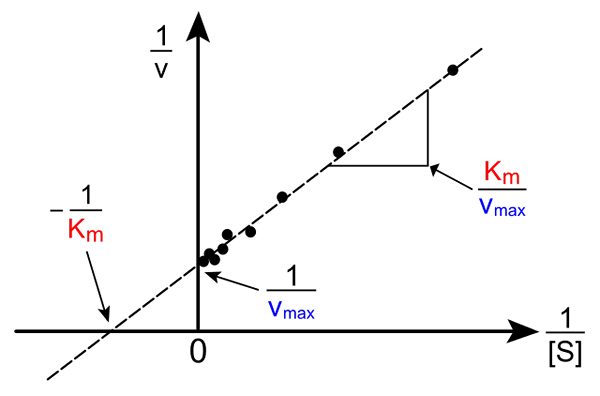 Lineweaver-Burk Straight. Kilde: Pro Bug Catcher via Wikipedia.
Lineweaver-Burk Straight. Kilde: Pro Bug Catcher via Wikipedia. Transformasjonen av Michaelis-Muene-ligningen for å produsere sin inverse form har følgende form:
1/v = (kM / VMaks) (1 / [s]) + 1 / vMaks
Viktigheten av denne linjen er at den har et kryss med x -aksen i - 1/kM, og med y -aksen ved y = 1/vMaks (Øvre bilde). Linjen har en skråning av kM/Vmax. Dette tillater informasjon om VMaks og kM Grafering av inverse av hastigheter avhengig av inverse av underlagskonsentrasjoner.
Referanser
- Strayer, l. (1975). Biokjemi. 2gir Utgave. Redaksjon tilbake.
- Iran. Levine. (2009). Prinsipper for fysikjemi. Sjette utgave. Mc Graw Hill.
- Wikipedia. (2020). Enzymkinetikk. Hentet fra: i.Wikipedia.org
- Michael Blaber. (5. juni 2019). Enzymkinetikk. Biologi librettexts. Gjenopprettet fra: Bio.Librettexts.org
- Redaktørene av Enyclopaedia Britannica. (2020). Michaelis-Muen Kinetics. Gjenopprettet fra: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biokjemi. 5. utgave. New York: W H Freeman; (2002). Avsnitt 8.4: Michaelis-modellen står for de kinetiske egenskapene til mange enzymer. Gjenopprettet fra: NCBI.NLM.NIH.Gov

