Protein denaturering hva som er, faktorer, konsekvenser
- 4800
- 1031
- Magnus Sander Berntsen
Hva er denaturering av proteiner?
De protein denaturering Den består av tapet av tre -dimensjonal struktur på grunn av forskjellige miljøfaktorer, for eksempel temperatur, pH eller visse kjemiske midler. Tapet av strukturen resulterer i tap av den biologiske funksjonen assosiert med det proteinet, enten enzymatisk, strukturell, transportør, blant andre.
Strukturen til proteinet er svært følsom for endringer. Destabiliseringen av en enkelt essensiell hydrogenbro kan denaturalisere proteinet. På samme måte er det interaksjoner som ikke er strengt avgjørende for å oppfylle proteinfunksjonen, og i tilfelle av å bli destabilisert har det ingen innvirkning på operasjonen.
Proteinstruktur
For å forstå proteindenatureringsprosessene, må vi vite hvordan proteiner er organisert. Disse har primær, sekundær, tertiær og kvartær struktur.
Primærstruktur
Det er aminosyresekvensen som utgjør dette proteinet. Aminosyrer er de grunnleggende blokkene som utgjør disse biomolekylene, og det er 20 forskjellige typer, hver med spesielle fysiske og kjemiske egenskaper. De går sammen ved hjelp av en peptidlink.
Sekundær struktur
I denne strukturen begynner denne lineære kjeden av aminosyrer å bli brettet med hydrogenbroer. Det er to grunnleggende sekundære strukturer: α -propellen, spiralformet; og det sammenleggbare bladet β, når to lineære kjeder er på linje parallelt.
Tertiær struktur
Det involverer andre typer krefter som resulterer i spesifikk folding av den tre -dimensjonale formen.
R -kjedene til aminosyrerester som utgjør strukturen til proteinet kan danne disulfidbroer og de hydrofobe delene av proteinene er gruppert inne, mens hydrofiler vender mot vannet i vannet. Van der Waals styrker fungerer som en stabilisator av interaksjonene som er beskrevet.
Kan tjene deg: isoleucine: egenskaper, funksjoner, biosyntese, matKvartær struktur
Den består av aggregater av proteinenheter.
Når et protein er denaturert, mister det kvartær, tertiær og sekundærstruktur, mens den primære forblir intakt. Proteiner som er rike på disulfidforbindelser (tertiær struktur) gir større denatureringsmotstand.
Faktorer som forårsaker denaturering
Enhver faktor som destabiliserer ikke -kovalente bindinger som er ansvarlige for å opprettholde den opprinnelige strukturen til proteinet, kan produsere detaturering. Blant de viktigste kan vi nevne:
Ph
Ved svært ekstreme pH -verdier, enten det er sure eller grunnleggende midler, kan protein miste sin tre -dimensjonale konfigurasjon. Overskuddet hones h+ Og åh- i midten destabiliserer proteininteraksjoner.
Denne endringen av ionemønsteret produserer denaturering. PH -denaturering kan være reversibel i noen tilfeller, og i andre irreversible.
Temperatur
Termisk denaturering oppstår ved å øke temperaturen. I organismer som lever i gjennomsnittlige miljøforhold, begynner proteiner å destabilisere ved temperaturer større enn 40 ° C. Det er klart at termofile organismproteiner kan støtte disse temperaturområdene.
Temperaturøkninger oversettes til økning i molekylære bevegelser som påvirker hydrogenbroer og andre ikke -kovalente bindinger, noe som resulterer i tap av tertiær struktur.
Disse temperaturene øker til reaksjonshastighet, hvis vi snakker om enzymer.
Kjemiske substanser
Polare stoffer - for eksempel urea - i høye konsentrasjoner påvirker hydrogenbroer. På samme måte kan ikke -polare stoffer ha lignende konsekvenser.
Vaskemidler kan også destabilisere proteinstrukturen; Imidlertid er det ikke en aggressiv prosess, og de er stort sett reversible.
Kan tjene deg: tysk kakerlakk: egenskaper, reproduksjon, matReduserende midler
Β-Mercaptoetanol (HOCH2CH2SH) er et hyppig bruk av kjemisk middel i laboratoriet for å denaturalisere proteiner. Det er ansvarlig for å redusere disulfidbroer mellom aminosyreavfall. Kan destabilisere den tertiære eller kvartære strukturen til proteinet.
Et annet reduksjonsmiddel med lignende funksjoner er Ditiotreitol (DTT). I tillegg er andre faktorer som bidrar til tap av naturlig struktur i proteiner tungmetaller i høye konsentrasjoner og ultrafiolett stråling.
Konsekvenser av protein denaturering
Når denaturalisering skjer, mister proteinet sin funksjon. Proteiner fungerer optimalt når de er i hjemlandet.
Tapet av funksjonen er ikke alltid assosiert med en denatureringsprosess. En liten endring i proteinstrukturen kan føre til tap av funksjon uten å destabilisere hele den tre -dimensjonale strukturen.
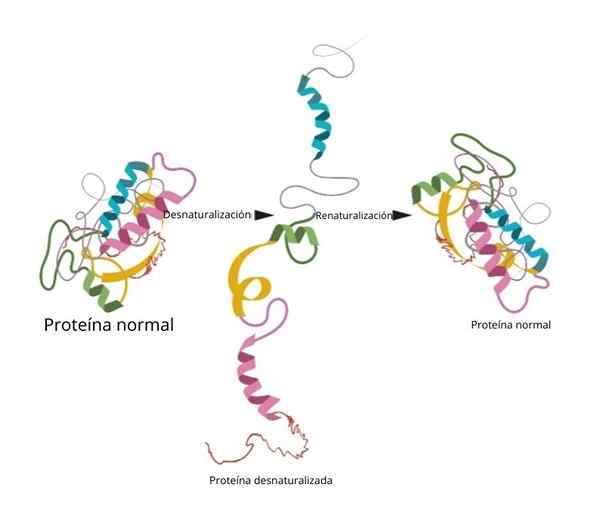
Prosessen er kanskje ikke irreversibel. På laboratoriet, hvis forholdene er omgjort at proteinet går tilbake til den første konfigurasjonen.
Renaturalisering
Et av de mest kjente og avgjørende eksperimentene på renaturalisering ble bevist i ribonukleasen til.
Når forskerne la til denatureringsmidler som urea eller ß-merkaptanol, ble proteinet denaturert. Hvis disse midlene ble fjernet, returnerte proteinet til sin opprinnelige konformasjon og kunne utføre sin funksjon med 100 % effektivitet.
En av de viktigste konklusjonene ved denne forskningen var å eksperimentelt demonstrere at den tre -dimensjonale konformasjonen av proteinet er gitt av dets primære struktur.
I noen tilfeller er denaturaliseringsprosessen helt irreversibel. Når vi for eksempel koker et egg, bruker vi varme i proteiner (det viktigste er albumin) som utgjør det, tar det klare et solid og hvitaktig utseende. Intuitivt kan konkludere med at selv om vi avkjøler det, vil den ikke komme tilbake til den første skjemaet.
Kan tjene deg: Ovogenese: Faser, egenskaper hos dyr og planterI de fleste tilfeller er denaturaliseringsprosessen ledsaget av tap av løselighet. Viskositet, diffusjonshastighet reduseres og krystalliserer lettere.
Chaperonas proteiner
Chaperonas eller chaperoninproteiner er ansvarlige for å forhindre denaturering av andre proteiner. De undertrykker også visse interaksjoner som ikke er tilstrekkelige blant proteiner for å sikre en riktig folding av dem.
Når den medium temperaturen øker, øker disse proteinene konsentrasjonen og virker ved å forhindre denaturering av andre proteiner. Dette er grunnen til at de også kalles "termiske sjokkproteiner" eller HSP for dets forkortelse på engelsk (Varmesjokkproteiner).
Chaperoniner er analoge med et bur eller tønne som beskytter proteinet av interesse inne.
Disse proteinene som reagerer på cellulære stresssituasjoner er rapportert i forskjellige grupper av levende organismer og er sterkt bevart. Det er forskjellige typer chaperoniner og klassifiseres i henhold til molekylvekten.

