Aktiveringsenergi

- 4709
- 457
- Prof. Joakim Johansen
Vi forklarer hva som er aktiveringsenergien, dens formel, enheter, hvordan den beregnes og vi gir flere eksempler
Hva er aktiveringsenergi?
De aktiveringsenergi (OGtil) Det er definert som minimumsenergi som er nødvendig for at en kjemisk reaksjon skal utføres. Med andre ord, det er energibarrieren som må overvinnes slik at reagenser kan bli produkter.
Aktiveringsenergi kan sees i handling i dagliglivet. Vi vet alle at når du åpner gassens passeringsnøkkel på kjøkkenet, brenner det ikke umiddelbart når det kommer i kontakt med luften.
Slik at forbrenningsreaksjonen begynner, er det nødvendig å gi en gnist eller brann av en kamp på. Denne gnisten eller denne brannen representerer aktiveringsenergien til forbrenningsreaksjonen.
Hvorfor kreves en aktiveringsenergi?
For å forstå grunnen til at reaksjoner trenger en minimumsenergi for å oppstå, er det viktig å forstå, i utgangspunktet hvordan de oppstår. For to atomer eller molekyler for å reagere, må de først kollidere. I tillegg må de gjøre det med riktig orientering slik at nye kjemiske bindinger kan dannes og de gamle kan bryte.
Selv om de to molekylene er rettet mot hverandre med den perfekte orienteringen, sikrer dette imidlertid ikke at en effektiv kollisjon blir gitt, på grunn av frastøtningen mellom elektronene på overflaten til molekylene.
Av denne grunn er det nødvendig at molekylene i tillegg til en riktig orientering også beveger seg med litt hastighet eller med noen minimum kinetisk energi som sikrer at kollisjonen er sterk nok til å motvirke frastøtningen av elektroner.
Denne minimum kinetiske energien som er nødvendig på mikroskopisk nivå er den som oversettes til reaksjonsaktiveringsenergien.
Kan tjene deg: litiumbromid: struktur, egenskaper, bruksområder, risikoerDet som sees i et energisiagram?
Et energidiagram er en grafisk representasjon som viser hvordan reagensens energi varierer når de blir omdannet til produkter. I disse diagrammer, for eksempel den som er presentert nedenfor, er det lett å se og tolke aktiveringsenergi.

I denne grafen viser den blå linjen energien når reaksjonen utvikler seg. Her kan du se at for å bli produktene, må reagensene først overvinne en høyde for å nå overgangstilstanden. Ellers blir de returnert til sin opprinnelige tilstand.
Høyden på denne bakken er nøyaktig aktiveringsenergi. Hvis det er mulig å overvinne, er resten av veien nedoverbakke, og reagensene blir raskt til å bli produktene.
Aktiveringsenergienheter
Aktiveringsenergi er en intensiv størrelse som kommer til uttrykk i energienheter over masse eller føflekker. Siden det er forskjellige energienheter og forskjellige masseenheter, kan aktiveringsenergi uttrykkes i flere forskjellige enheter. De som brukes hyppigst i kjemi er imidlertid:
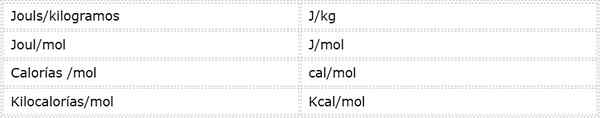
Hvilken enhet som brukes avhenger av dataene den beregnes fra, eller bruken som vil bli gitt i andre beregninger.
Aktiveringsenergiformel
Aktiveringsenergi er relatert til reaksjonshastighet. Faktisk, jo større aktiveringsenergi, jo lavere er hastigheten. Dette forholdet uttrykkes matematisk gjennom Arrhenius -ligningen, som relaterer hastighetskonstanten til en reaksjon på temperaturen.
Kan tjene deg: Benedict Reagent: Hva er det for, komponenter, forberedelser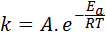
I denne ligningen, k Det er hastighetskonstanten for reaksjonen, ogtil Det er aktiveringsenergien, R er konstanten av de ideelle gassene, T er den absolutte temperaturen og kalles Arrhenius pre-Exponential Factor, også kalt en kollisjonsfaktor.
Denne ligningen kan omorganiseres for å gi:
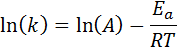
Hvis verdien av a for reaksjonen er kjent, kan aktiveringsenergien oppnås ved å fjerne den forrige ligningen. Dette er imidlertid ikke måten aktiveringsenergien til en reaksjon vanligvis bestemmes. Normalt bestemmes hastighetskonstanten ved to eller flere temperaturer, noe som gjør det unødvendig å vite.
Hvordan beregnes aktiveringsenergi?
Aktiveringsenergi bestemmes ut fra hastighetskonstanten ved forskjellige temperaturer ved forskjellige temperaturer. Minst to verdier av k målt ved forskjellige T -verdier for å beregne aktiveringsenergi uten å vite det, noe som vanligvis er tilfelle.
Avhengig av hvor mange verdier av k De har, du kan beregne ogtil På to måter:
1. Når du har k Ved to temperaturer
I disse tilfellene er det lettere å starte fra den første formen for Arrhenius -ligningen. Hvis vi ringer k1 til hastighetskonstanten ved temperaturen T1 og k2 til hastighetskonstanten ved temperaturen T2, Da kan vi skrive Arrhenius -ligningen to ganger:
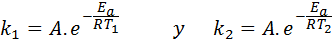
Nå kan vi dele noen av de to ligningene mellom den andre for å avbryte en:
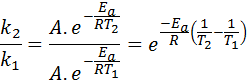
Deretter tar neperisk logaritme på begge sider og løser for Etil, er oppnådd:
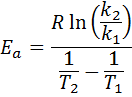
2. Når du har k Mer enn to temperaturer
I tilfeller der det er flere bestemmelser av hastighetskonstanten ved forskjellige temperaturer, er det å foretrekke å finne aktiveringsenergien grafisk eller ved hjelp av lineær regresjon. Dette er basert på ligningen i logaritmisk form, som har formen på en linje:
Det kan tjene deg: Clausius-Clapeyron-ligning: Hva er det for, eksempler, øvelser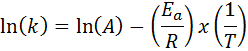
Hvis vi lager en graf over Ln (k) kontra (1/t), vil vi få en rett linje som kutter til aksen og i ln (a) og hvis skråning er lik -(etil/R). Derfra oppnås aktiveringsenergien.
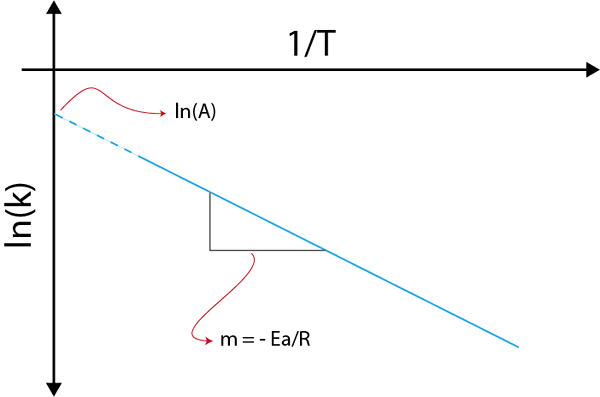 Arrhenius -graf for å bestemme aktiveringsenergi
Arrhenius -graf for å bestemme aktiveringsenergi Eksempler på beregning av aktiveringsenergier
Eksempel 1
Hastighetskonstanten for en første -ordre -reaksjon ble bestemt ved to forskjellige temperaturer. 298 K hadde en verdi på 0.058 s-1, mens 350 k økte verdien til 0,425 s-1. Bestem aktiveringsenergien til denne reaksjonen i J/mol.
- Løsning: Ettersom du har konstant ved to temperaturer, kan aktiveringsenergiformelen vist ovenfor brukes direkte. Ettersom energien blir bedt om i J/mol -enheter, må vi bruke gassen konstant i disse enhetene:
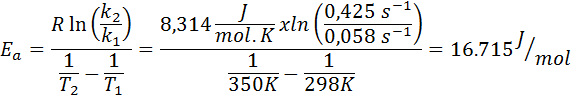
Eksempel 2
Hastighetskonstant for en annen ordre kjemisk reaksjon måles ved forskjellige temperaturer. Verdiene presenteres i følgende tabell. Bestem aktiveringsenergien i kcal/mol.
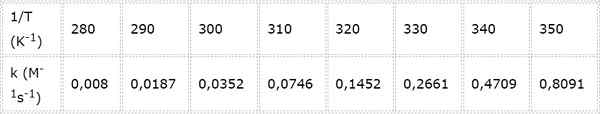
- Løsning: Som i dette tilfellet er det flere temperaturer, det er å foretrekke å bestemme aktiveringsenergien grafisk. For å gjøre dette er det laget en graf over Ln (k) vs 1/t, som presenteres nedenfor.
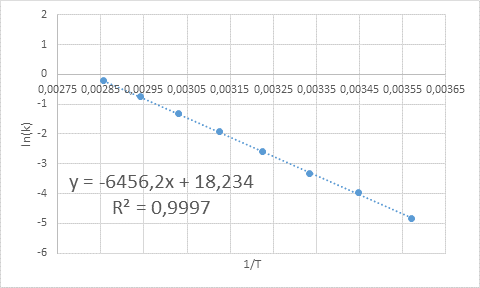 Eksempel på grafisk bestemmelse av aktiveringsenergi
Eksempel på grafisk bestemmelse av aktiveringsenergi Fra ligningen på linjen vist i grafen oppnås skråningen, som er -6456.2. Ettersom skråningen (m) er lik - etil/R, da:
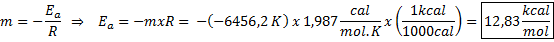
Det vil si at aktiveringsenergien til denne reaksjonen er 12,83 kcal/mol.

