Ikke -polar kovalent binding
- 1299
- 181
- Oliver Christiansen
Vi forklarer hva en ikke -polar kovalent binding er, dens egenskaper og flere eksempler
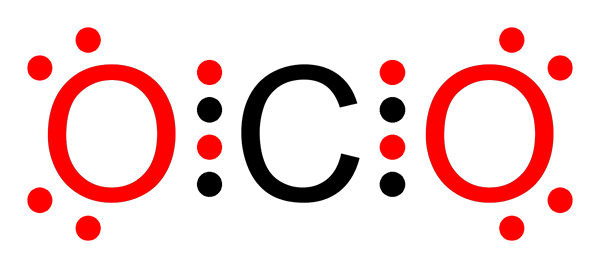
 Ikke -polar kovalent binding av karbondioksid
Ikke -polar kovalent binding av karbondioksid Hva er en ikke -polar kovalent binding?
EN Ikke -polar kovalent binding, Også kalt ren eller apolar kovalent binding, det er foreningen av to atomer som deler ett eller flere elektronpar likt. Med andre ord.
Denne typen koblinger er mellom to like atomer (av samme element) eller mellom to forskjellige atomer, men som har veldig like elektronegativiteter.
Det er tre typer kjemiske koblinger som holder atomene sammen med hverandre. Disse er: den ioniske bindingen, den kovalente bindingen og den metalliske lenken. Disse koblingene er forskjellige i henhold til hvordan elektroner er fordelt rundt atomer.
Når det gjelder kovalente bindinger, deler de to atomene valenselektronene, noe som betyr at disse elektronene, i stedet for å dreie seg rundt et atom, dreier. Dette er imidlertid ikke alltid rettferdig, siden elektroner foretrekker å bruke mer tid i nærheten av det mest elektronegative atomet, og gir opphav til en polar kovalent binding.
Når det.
Kjennetegn på den ikke -polare kovalente lenken
1. De dannes mellom atomer med like eller veldig like elektronegativiteter
De er kovalente koblinger som dannes mellom like atomer eller som har veldig like elektronegativiteter. Generelt anses en kovalent binding som ikke polar hvis elektronegativitetsforskjellen er mindre enn eller lik 0,4.
Kan tjene deg: Succinic Acid: Struktur, egenskaper, innhenting, bruk2. De kan være enkle, doble eller trippel
Avhengig av antall par elektroner som både atomer deler, kan ikke -polare eller apolare kovalente bindinger være enkle, doble eller trippel.
Når bindingen dannes av et enkelt par elektroner, kalles det en enkel kobling, når to elektronpar deles, kalles det en dobbeltbind.
3. De involverer nesten alltid ikke -metaller
Metaller er elementer med veldig lave elektronegativiteter som danner metallforbindelser til hverandre. Når de er koblet til ikke -metaller, danner de alltid enten ioniske bindinger eller polare lenker. Av denne grunn dannes ikke ikke -polare kovalente bindinger mellom ikke -metalliske elementer som hydrogen og karbon.
4. De gir opphav til apolare forbindelser
En forbindelse som bare har ikke -polar kovalente bindinger, vil bli dannet av apolare molekyler. Disse typer forbindelser er preget av å ha lave kokende og fusjonspunkter sammenlignet med metaller og ioniske forbindelser (noen er til og med gasser ved romtemperatur), de er uoppløselige i vann og er dårlige ledere av varme og elektrisitet.
5. De kan danne faste, flytende eller gassformige forbindelser ved romtemperatur
Forbindelser med ikke -polare kovalente bindinger kan ha lave, men veldig variert koke- og fusjonspunkter.
På grunn av dette er noen av dem gasser ved romtemperatur (for eksempel hydrogen, h2, og nitrogen, n2), andre er væsker (for eksempel brom, br2), mens andre er solide (for eksempel naftalen, c10H8).
6. De har relativt lave koblingsenergier.
Sammenlignet med ioniske koblinger, er ikke -polare kovalente bindinger lettere å bryte, siden de har en lavere koblingsenergi. Dette betyr at du må bruke mindre energi for å bryte en ikke -polar kovalent binding enn en ionisk binding.
Kan tjene deg: støkiometriske loverEksempler på ikke -polare kovalente lenker
H-H-kobling i hydrogenmolekylet (h2)
I hydrogenmolekylet, h2, To hydrogenatomer deler sine eneste valenselektroner for å danne en enkel kovalent binding.
 Hydrogenmolekyl
Hydrogenmolekyl Ettersom begge atomene er de samme, vil forskjellen i elektronegativiteter mellom de to være null, så denne koblingen er en ikke -polar kovalent binding.
F-F-kobling i fluormolekylet (f2)
Dette eksemplet fremhever det faktum at det ikke spiller noen rolle elektronegativiteten til et atom, men forskjellen i elektronegativiteter til de to atomene som danner en kobling for å vite om lenken vil være kovalent ikke polar eller ikke.
 Fluormolekyl
Fluormolekyl Fluor er det mest elektronegative elementet i det periodiske tabellen, så det har en tendens til å fjerne elektronene fra de andre elementene for å danne polare eller ioniske bindinger.
Men når et atom av fluor er knyttet til et annet lik ham, kan ingen av Ikke -polar kovalent lenke.
O-O-koblinger i ozonmolekylet (eller3)
Som i tilfelle av fluormolekyl, er oksygen også et veldig elektronegativt element. Imidlertid, ved å danne koblinger med andre oksygenatomer, danner det ikke -polare kovalente bindinger. Slik er tilfellet med ozonmolekylet.
 Ozonmolekyl
Ozonmolekyl I dette tilfellet er det sentrale oksygenatomet knyttet til to andre oksygenatomer ved hjelp av ikke -polare eller apolare kovalente bindinger.
Kan tjene deg: magnesiumoksyd: struktur, egenskaper, nomenklatur, brukN-n lenke i nitrogenmolekylet (n2)
Nitrogenmolekylet inneholder en ikke -polar kovalent binding, der hvert nitrogenatom deler sine tre valenselektroner forsvant med den andre.
 Nitrogenmolekyl
Nitrogenmolekyl Av denne grunn deler begge atomene totalt tre par elektroner, og danner dermed en trippel kovalent binding.
C-H-koblinger i metanmolekylet (CH4)
Metan er et eksempel på en ikke -polar kovalent binding dannet mellom atomer med forskjellige elementer, i dette tilfellet karbon og hydrogen.
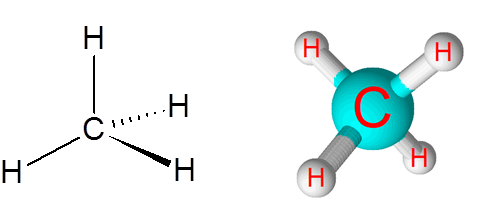 Metanmolekyl
Metanmolekyl Forskjellen i elektronegativitet mellom de to elementene er 0,4 som plasserer denne grensen bare mellom ikke -polare og polare bindinger.
Link C = C i etylenmolekylet (C2H4)
Etylenmolekylet, også kalt Eteno, har totalt fem lenker. Fire C-H-koblinger og en dobbeltbinding C = C. I begge tilfeller tilsvarer koblingene ikke -polare eller apolare kovalente bindinger.
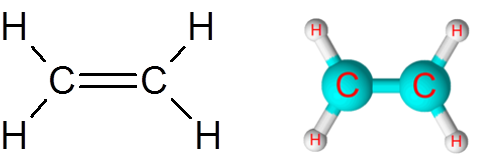 Etylenmolekyl
Etylenmolekyl
- « 6 danser og danser typiske for Quintana Roo mer berømt
- De 9 dansene og typiske dansene til Michoacán mer berømt »

