Kondensert formel Hva er og eksempler (metan, etan, glukose ...)
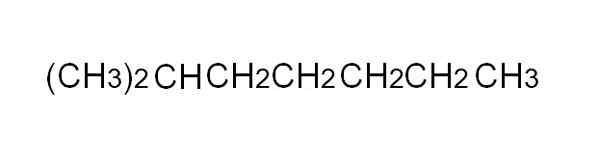
- 1169
- 39
- Jonathan Carlsen
De Kondensert formel Det er en rent tekstlig representasjon av et molekyl der koblingene er utelatt. Formålet er å vite hva som er bestillingen av atomer. Generelt lineære eller forgrenede molekyler har kondenserte formler, bortsett fra sykliske eller de som er svært forgrenede.
I organisk kjemi er det vanligvis forvirring av hva som er forskjellen mellom denne formelen og molekylæren. Det er faktisk vanlig å finne dem som synonymer. I mellomtiden, i uorganisk kjemi, brukes molekylære formler mer, siden de kovalente forbindelsene i de fleste tilfeller med rette beskriver; Som vann, h2ENTEN.
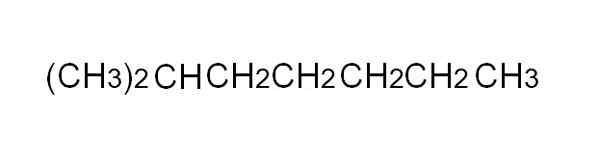 Kondensert formel av 2-metylheptano. Kilde: Gabriel Bolívar.
Kondensert formel av 2-metylheptano. Kilde: Gabriel Bolívar. [TOC]
Hva er den kondenserte formelen?
For å definere det mer praktisk, er den kondenserte formelen en forenklet representasjon av semi -utviklet. Det er ikke nødvendig å skrive de enkle koblingene, og det skal heller ikke dekke mer enn en linje i en tekst. For eksempel kan 2-metylheptano, en forgrenet alkan, være representert i samme linje som i det øvre bildet.
Kondenserte formler er nyttige for å representere noen molekyler uten å måtte tegne dem. Dette er utmerket når kjemiske ligninger skrives der sykliske eller veldig forgrenede molekyler ikke deltar. Det vil sees at disse formlene tyr til parenteser for ytterligere å forenkle representasjonen av et molekyl.
Eksempler
Metan
Metan er den eneste kjemiske forbindelsen som har en enkelt formel: CH4. Dette tilsvarer den empiriske, molekylære, kondenserte og semi -utviklede samtidig. Det er grunnen til at mange ganger, for å spare en forvirring mellom alle disse konseptene, foretrekker folk å henvise enkle og upresis til den 'kjemiske formelen' av en forbindelse.
Etano
Estano har en molekylær formel C2H6. Den kondenserte formelen i stedet er Cho3Ch3. Merk at C-C-lenken og C-H-koblingene er utelatt. Tanken er å kunne skrive formelen som om det var et "ord", uten å måtte tegne striper eller tegne strukturer.
Kan tjene deg: pycnerometerPer definisjon er den molekylære formelen C2H6 og ikke Ch3Ch3; For enkle molekyler er begge formlene imidlertid vanlige å utveksle, selv om det fremdeles er feil. Dette er et avvikspunkt mellom flere kilder, der det tilsynelatende er spesifikke regler i denne forbindelse.
Glukose og fruktose
Her er et eksempel der en feil umiddelbart blir observert når du vil utveksle molekylformelen for kondensatet.
Det søte, glukose og fruktose -dreiemomentet har den samme molekylære formelen: C6H12ENTEN6, Og derfor tjener dette ikke til å differensiere dem. I kontrast etablerer strukturelle og semi -utviklede formler forskjellige molekyler i sikte.
Imidlertid har glukose eller fruktose en kondensert formel. Dette er fordi uansett representasjon eller projeksjon, kan ikke strukturene deres skrives på samme linje; Eller i det minste, på en måte som er hyggelig og enkel i leserens øyne.
Butan
Butano har en molekylær formel C4H10. Den har to isomerer: det lineære, n-Butano, og forgrenet, 2-metylpropan. Begge kan være representert med deres kondenserte formler. Han n-Butano er Ch3Ch2Ch2Ch3 eller Ch3(Ch2)2Ch3, Og 2-metylpropan er Cho3Ch (Ch3)2 eller (kap3)3Ch.
I 2-metylpropan har vi en gruppe CH omgitt av tre CHO3. De to formlene er gyldige, og parenteser brukes til å fremheve konsekvensene, og abonnementet er en indikator på hvor mange grupper som utgjør denne grenen.
Etanol
Etanol har en kondensert formel CH3Ch2Åh. Legg merke til hvor mye det ligner den halvutviklede formelen: CH3-Ch2-Åh. På samme måte er det gjort med Propanol, Cho3Ch2Ch2Å, The n-Butanol, kap3Ch2Ch2Ch2Å, og med alle andre alkoholer.
Kan tjene deg: natriumfosfat: struktur, egenskaper, syntese, brukHvis de har en gren, vil det bli indikert i en parentes til atomets rett som det er koblet. For eksempel kan 2-metylbutanol skrives som: CH3Ch2Ch (Ch3) Ch2Åh. Merk at for mange molekyler begynner det å være mer praktisk å ty til en strukturell eller semi -utviklet formel.
Pentano
Pentanens lineære isomer, n-Pentano, det er lett å representere for sin kondenserte formel: Cho3Ch2Ch2Ch2Ch3. Denne formelen kan også forenkles ved hjelp av parenteser: CH3(Ch2)3Ch3, indikerer at mellom de to CH3 Det er tre CH2.
De to andre isomerer av pentanen er imidlertid litt mer kompliserte: CH3Ch2Ch (Ch3)2, For 2-metylbutan, og C (CH3)4 For 2,2-dimetylpropan eller neopantum. Merk at karbonatom til venstre for parentesen er den som danner koblinger til substituenter eller forgreninger.
Octane
Den lineære isomeren av oktanen, n-Octane, på grunn av lengden, er det nå aktuelt å representere dens kondenserte formel som Cho3(Ch2)6Ch3. Det er på dette tidspunktet hvor noe klart av kondenserte formler skal være: de søker å spare tid når de representerer molekyler eller forbindelser, uten å skrive så mye på papir.
Cyclohexan
Tilfellet med cykloheksanen ligner på glukose og fruktose: Mangler formelt en kondensert formel for å være en syklisk forbindelse. En måte å prøve å representere det ville være: (CH2)6, som innebærer at seks grupper cho2 De må være koblet sammen, bare være mulig hvis de stenger i en sekskantet ring. Imidlertid er det bedre å tegne ringen.
Aceton
Aceton presenterer særegenheten ved å ha en karbonylgruppe, C = O. For å skrive din kondenserte formel har vi derfor tre alternativer: (CH3)2Co, kap3C (O) CH3 eller Ch3(C = O) CH3.
Kan servere deg: kaffesyre: struktur, egenskaper, biosyntese, brukI større molekyler er faktisk karbonylgruppen vanligvis representert som (o), under hensyntagen til at karbonatom til venstre er den som danner dobbeltbindingen med oksygen, c = o.
Eddiksyre
Den kondenserte formelen for eddiksyre er CHO3COOH O CH3Co2H. Her er et viktig poeng: de funksjonelle gruppene skrevet i samme linje er deler av en kondensert formel. Dette var tilfelle etanol og aceton, og gjelder også Thioles (-sh), Aldehydos (-cho) Esters (-CO2R o -Coor) og aminer (-NH2).
Generell kommentar
Det er mange forvirring mellom molekylære og kondenserte formler. Kanskje er det fordi disse representasjonene alene allerede gir et omtrentlig bilde av molekylet, så vi tror det er den molekylære formelen.
Også formler som C6H12ENTEN6 De regnes også som kondensat, fordi de er forenklet, "kondenserer" molekylet i atomer og abonnement. Det er derfor det er vanlig å se hvordan de to formlene blir nevnt som om de var synonymer.
I mange kilder, inkludert Wikipedia -artikler, brukes begrepene 'kjemisk formel' for å referere til molekylær (type C6H12ENTEN6 og andre), og 'formel' for å referere til kondensatet.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (18. november 2019). Kondensert formeldefinisjon i kjemi. Gjenopprettet fra: Thoughtco.com
- James Ashenhurst. (11. desember 2019). Kondenserte formler: Dechiffrering av hva ryggen betyr. Master Organic Chemistry. Gjenopprettet fra: MasterorganicChemistry.com
- Copolingenieria. (2. mai 2016). Empirisk, strukturell og kondensatformel. Hentet fra: ChemioteCablog.WordPress.com
- Introduksjon til kjemi: Generelt, organisk og biologisk. (s.F.). Kondenserte strukturelle og linjevinkelformler. Gjenopprettet fra: 2012 bøker.Lardbucket.org

