Hydrazinstruktur, egenskaper, syntese, bruker

- 1664
- 322
- Dr. Andreas Hopland
De Hydrazin Det er en uorganisk forbindelse hvis kjemiske formel er n2H4. Det består av et medlem av familien av nitrogenhydror, den enkleste er den enkleste av alle å være. Selv om molekylet virker enkelhet, viser det flere kjemiske og fysiske egenskaper som gjør hydrazin til et interessant og energisk lovende stoff.
Hold en nær likhet med vann, ettersom begge eksisterer som flytende stoffer i lignende temperaturintervaller. Fra hydrazin kan vi skaffe organiske derivater ved å erstatte hydrogener med kullsyreholdige grupper. Også fra det syntetiserte hydrazoner, hydrazider og hydrazinsalter.
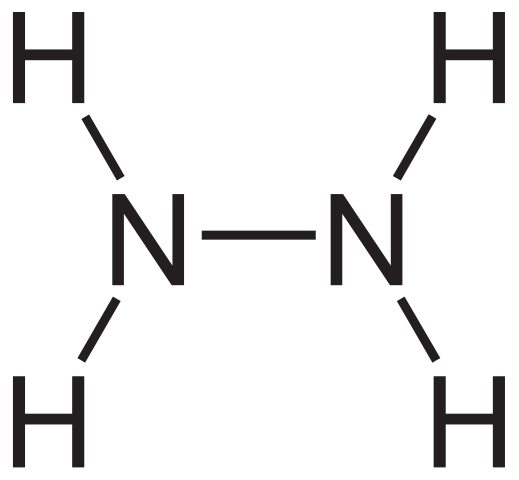 Hydrazin strukturell formel. Kilde: Neurotoger via Wikipedia.
Hydrazin strukturell formel. Kilde: Neurotoger via Wikipedia. Den strukturelle formelen til hydrazin kan sees ovenfor, som kan skrives som h2NNH2 eller h2N-nh2. Hvis du ser nøye ut, ser det ut til at to NH -molekyler3 De ville ha koblet til hverandre. Imidlertid er ikke bare ammoniakkmolekyler i dannelsen av N-N-koblingen ikke bare ammoniakkmolekyler som reagenser.
Hydrazin er en forbindelse som har flere applikasjoner, fordi det er en utmerket forløper for symfiner av forbindelser, både organisk og uorganisk. På samme måte, takket være den reduserende kraften og dens nedbrytningsprodukter, er den bestemt til å eliminere oksygen og andre gasser, oppnå edle metaller; Og spesielt for å øke romfartøyet og staten -av -art -flyet.
[TOC]
Hydracinstruktur
Molekyl og lenke
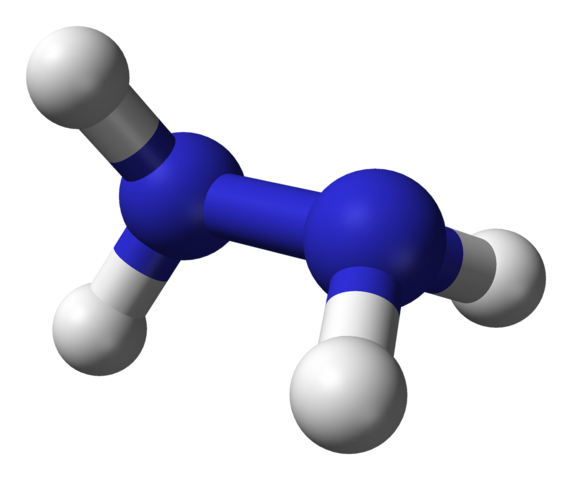 Molekylær struktur av hydrazin. Kilde: Ben Mills via Wikipedia.
Molekylær struktur av hydrazin. Kilde: Ben Mills via Wikipedia. I det øvre bildet har vi hydrazinmolekylet representert av en kuler og bars -modell. Legg merke til at den romlige orienteringen av hydrogenatomer, hvite kuler, står i kontrast til inntrykket som tilbys av strukturformelen; det vil si hydrogenene til begge -nh2 De er ikke justert eller formørket, men har en 95º rotasjonsvinkel med hverandre.
Det er faktisk så mye at N-N-koblingen knapt er i stand til å rotere, og ha en energisbarriere som må utløpes for å formørke de fire hydrogenatomer.
Hva handler dette om? I prinsippet, til sterke elektroniske frastøtninger som gjensidig opplever de to parene med ensomme elektroner på nitrogenatomer. Denne 95º vinkelen er den som gir hydrazinmolekylet den største stabiliteten.
Kan tjene deg: litiumbromid: struktur, egenskaper, bruksområder, risikoerGeometrier
Hvert nitrogenatom har en SP -hybridisering3, Vedtak av en trekantet pyramidegeometri. Derfor, med de frie elektronparene, kan hydracinmolekylet slik som to pyramider koblet sammen med en av de hjørnerne visualiseres, og i hvis sentre nitrogenatomer ville være lokalisert ville være lokalisert.
Intermolekylære interaksjoner
Formelen h2NNH2 Jeg kunne gi den falske ideen om at hydrazin er en apolar forbindelse for å ha to like grupper koblet. Imidlertid viser molekylstrukturen og dens roterte N-N-binding at molekylet ikke er helt symmetrisk, og nevner også at deres gratis elektronpar ikke peker i motsatte retninger.
Dette betyr at hydrazin, som er strukturelt og elektronisk asymmetrisk, presenterer et dipolmoment. Og derfor samhandler molekylene deres med hverandre gjennom dipol-dipol2NNH2-NH2NH2, som er ansvarlige for at hydrazin har et veldig høyt kokepunkt.
Hydracinegenskaper
 Hydrazin hydrat. Kilde: LHCHEM/CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Hydrazin hydrat. Kilde: LHCHEM/CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0) Fysisk utseende
Hydrazin er en fargeløs væske som ligner vann når det gjelder viskositet og tetthet. Når forbrenningen avgir hvite damper, i tillegg til å få ammoniakk og fisk.
Molmasse
32.0452 g/mol
Smeltepunkt
2 ºC.
Kokepunkt
114 ºC. Merk at hydrazin eksisterer i flytende tilstand i temperaturintervallet 2-114 ºC, veldig likt vann, 0-100 ºC.
Tetthet
1.021 g/cm3
Damptetthet
1.1 i luftforhold.
Damptrykk
Rundt 0.010 atm på 30.7 ºC
Løselighet
Hydrazin er blandbar med vann, så vel som med flere primære alkoholer. Hydrazin danner et hydrat med vann, n2H4· H2Eller, som er preget av å være tettere enn ren eller vannfri hydrazin. Dette hydratet er det mest markedsførte produktet, siden det er mer stabilt og billig.
Dipolar øyeblikk
1.85 d. Det er et ganske polært stoff, nesten det samme som vann.
Det kan tjene deg: Yodium Acid (HIO3): Struktur, egenskaper, risikoer og bruksområderGoo
0.876 cp
Flash Point
52 ºC
Selvordemperatur
Varierer avhengig av stoffer eller overflater som det kommer i kontakt. På jernoksider forbrenner for eksempel 23 ° C, mens det på glass eller andre containere ikke begynner å bli betent før 270 ºC.
Nedbrytning
Når den brenner i luften, dekomponerer den i nitrogenoksider, neix. Men når det gjelder den katalytiske nedbrytningen, det vil si at akselerert av metalloksider eller metall, oppnås produkter som ammoniakk, nitrogen og hydrogen, og en enorm mengde varme, som ender opp med å danne en brennende, men usynlig flamme.
Reaktivitet
Hydrazin er et godt reduksjonsmiddel, siden når oksidert produserer vann og nitrogen, har begge forbindelser som ikke lider sekundære reaksjoner.
På den annen side er hydrazin en nukleofil, ettersom den bruker sine gratis elektronpar for å bli sammen med andre organiske molekyler. På samme måte kan den lide erstatte3, Å produsere metylert derivater: CH3Nhnh2 eller (kap3)2NNH2.
Reagerer med sterke syrer for å danne hidrazinio salter, n2H5X, og fra hidrazonio, n2H6X2. Sistnevnte er de minst vanlige. Hydraziniumsulfat, [n2H5] HSO4, Det tilberedes ved å reagere hydrazinhydrat med svovelsyre.
Grunnleggende
Hydrazin er en svakere base enn ammoniakk:
N2H4(AC) + H2Eller (l) ⇌ n2H5+(AC) + OH-(AC)
Kb = 1.3 · 10-6
Dette er fordi hydrazinio konjugatsyre2H5+ eller h3N+-NH2, har belastningen destabilisert av attraktor -effekten av NH -gruppen2; Det vil si i stedet for å gi elektronisk tetthet til positivt nitrogen, tilbaketrekning.
Hydrazin er i stand til å lide et sekund, mye mindre sannsynlig protonasjon, noe som genererer en enda mer ustabil konjugert syre:
N2H5+(AC) + H2Eller (l) ⇌ n2H6+(AC) + OH-(AC)
Kb = 8.4 · 10-16
Hydrazoniet, n2H6+ eller h3N+-N+H3, Det er veldig ustabilt på grunn av frastøttene mellom de positive belastningene til begge nitrogenatomer. I selskap med visse anioner kan det imidlertid eksistere som et salt.
Toksisitet
Anhydra hydrazin er et ekstremt giftig, kaustisk og muligens kreftfremkallende stoff, for ikke å nevne at det er veldig eksplosivt, så det skal bare manipuleres under strenge sikkerhetsprotokoller.
Kan tjene deg: Komprimerbarhetsfaktor: Hvordan beregne, eksempler og øvelserSyntese
Den mest brukte metoden for å syntetisere hydrazin er Raschig -prosessen. Dette består av følgende to reaksjoner:
NH3(AC) + NaOCL (AC) → NH2Cl (AC) + NaOH (AC)
2nh3(AC) + NH2CL (AC) → N2H4(AC) + NH4CL (AC)
Til slutt dannes hydraten n2H4· H2Eller, som er destillert i nærvær av KOH eller NaOH som tørre faste stoffer:
N2H4· H2O → n2H4
På denne måten oppnås anhydrahydrazinet og N-N-koblingen dannes.
Hydrazin bruker
 Hydrazin er et av de mest verdsatte stoffene i luftfartsbommen. Kilde: Pxhere.
Hydrazin er et av de mest verdsatte stoffene i luftfartsbommen. Kilde: Pxhere. - Hydrazin, i nærvær av metallkatalysatorer, er eksotermisk brutt ned for å produsere nitrogen og hydrogen, og gir dermed nok energi til å øke fly, raketter og satellitter.
- Denne tendensen til å bryte sammen og forårsake gasser brukes nettopp for å blåse opp polymermaterialer, for eksempel gummi eller polyetylen, og gjør dem til sine respektive skum.
- På samme måte, ved å frigjøre gasser, kan disse dra andre som er oppløst i rør fra rørene, så det er veldig nyttig å eliminere oksygen fra kjeler, og dermed unngå at de korroderer.
- Hydrazin er et forløpermateriale for mange organiske forbindelser med farmakologiske funksjoner, soppdrepende midler, ugressmidler, insektmidler, gjødsel, etc. Dette er på grunn av det et bredt utvalg av sykliske nitrogenderivater er syntetisert.
- Til slutt brukes det å være et godt reduserende middel, hydrazin og dets hydraziniumsalter for å redusere edelt metallmineraler, og være av stor verdi i metallurgisk industri.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Hydrazin. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2020). Hydrazin. Pubchem Comunund sammendrag for CID 9321. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Redaktørene av Enyclopaedia Britannica. (2020). Hydrazin. Britannica Encyclopaedia. Gjenopprettet fra: Britannica.com
- Iridium neste. (20. juni 2017). Hydrazin - giftig for mennesker, men satellitter elsker det. Gjenopprettet fra: Iridium.com

