Natriumhydroksyd (NaOH) struktur, egenskaper, bruksområder, syntese

- 1811
- 531
- Prof. Oskar Aas
Han natriumhydroksyd Det er en uorganisk forbindelse hvis kjemiske formel er NaOH og består av en veldig sterk metallbase eller alkali. En 5 %løsning i vann har en pH nær 14.
Det er et veldig hygroskopisk hvitt fast stoff, og som også kan absorbere karbondioksid i luften for å danne natriumkarbonat. Kommersielt kommer i plastflasker som piller, som ikke kan utsettes for mye tid i luften, og de skal heller ikke manipuleres med spatler.
 Natriumhydroksydpiller på et klokke glass. Kilde: Ingen maskinlesbar forfatter gitt. Walkerma antatt (basert på copyright -krav). [Offentlig domene]
Natriumhydroksydpiller på et klokke glass. Kilde: Ingen maskinlesbar forfatter gitt. Walkerma antatt (basert på copyright -krav). [Offentlig domene] Natriumhydroksyd kan syntetiseres når du reagerer kalsiumhydroksyd med natriumkarbonat. For øyeblikket syntetiseres det grunnleggende ved saltlakeelektrolyse, og er et sekundært produkt av gassklorproduksjon.
Gi. Det brukes også i rengjøring av hjemmet, vannbehandling, aluminiumsbehandling, medisinproduksjon, etc.; Og fremfor alt er det et sekundært mønster par excellence.
Natriumhydroksyd er veldig etsende, å kunne produsere irritasjon og hudforbrenninger og øyne. Ved innånding av støvet kan det forårsake lungeødem. I mellomtiden kan inntaket forårsake så alvorlige skader på fordøyelseskanalen som kan føre til død.
[TOC]
Struktur
Vannfri
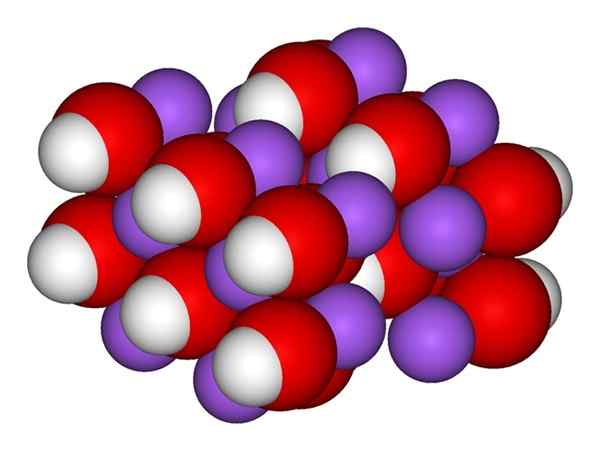
 NaOH -ioner. Kilde: Gabriel Bolívar.
NaOH -ioner. Kilde: Gabriel Bolívar. Det overlegne bildet viser ionene som utgjør NaOH. Na -kationen+ Det er representert av den lilla sfæren, mens hydroksylanion (hydroksyd eller oksydril) oh- For den røde og hvite sfæren. Begge Na -ionene+ Og åh- De samhandler med hverandre av den elektrostatiske tiltrekningen av motsatte belastninger.
 Natriumhydroksydstruktur
Natriumhydroksydstruktur Slike interaksjoner er ikke -retning, så attraksjonene til en ionisk NA+Åh- kan påvirke andre på en viss avstand. Resultatet er at naioner+ De frastøter hverandre, på samme måte som OH-, Inntil de definerer en minimumsenergikrystall der de etablerer en ordnet og periodisk struktur (krystallinsk).
Vises derfor de ortorrombiske krystaller av Naoh Anhydro (uten vann):
 Representasjon av den krystallinske strukturen av vannfri natriumhydroksyd. Kilde: Quibik via Wikipedia.
Representasjon av den krystallinske strukturen av vannfri natriumhydroksyd. Kilde: Quibik via Wikipedia. Ionene forblir sammenhengende nok for at NaOH -vannfri krystall baserer 323 ºC (forutsatt at det ikke er fuktighet i miljøet).
Hydrater
Begge Na+ Som åh- De er ioner som vannmolekyler solvetan (hydrat) lett. Dette favoriserer hydrasjonen over den retikulære energien i krystaller, så NaOH frigjør mye energi når det kommer i kontakt med vann.
Det kan tjene deg: Fehling -reaksjon: Forberedelser, aktive midler, eksempler, bruksområderImidlertid kan vannfrie krystaller være vertskap for vannmolekyler uten oppløsning; Det vil si at natriumhydroksyd kan danne mange hydrater, NaOH · NH2ENTEN. Vannmolekylet kan godt danne en hydrogenbro med OH- (Hoh-oh-), eller koordinere med NA+ (Na+-Åh2).
Avhengig av den molare andelen mellom NaOH og H2Eller, monohydrater kan oppstå (NaOH · H2O), dihydrater (NaOH · 2H2O), Trihemacrates (NaOH · 3.5H2O), tetrahydrater (NaOH · 4H2O), heptahridater (NaOH · 7H2O), og andre.
Hver disse hydratene kan krystallisere fra en vandig NaOH -løsning med forskjellige masseprosent og ved forskjellige temperaturer. Følgelig viser NaOH et komplisert vannløselighetsdiagram.
Generelt sett er hydratekrystaller mindre tette og har lavere smeltepunkter. Dette er fordi vannmolekylene "hindrer" interaksjonene mellom NA+ Og åh-, Legge til dipol-dipolkrefter i offer av ioniske attraksjoner.
Fysiske og kjemiske egenskaper
Navn
IUPAC foretrukket navn: natriumhydroksid. Andre navn: Caustic Soda, Ascarita (mindre vanlig)
Molmasse
39.9971 g/mol
Utseende
Faste eller hvite, serøse eller ugjennomsiktige krystaller.
Smeltepunkt
323 ºC
Kokepunkt
1.388 ºC
Vannløselighet
1.000 g/l ved en temperatur på 25 ºC. Dette demonstrerer hvor mye det kan oppløses i vann.
Dens vandige oppløsninger er tyktflytende, med en viskositetsverdi nær åtti ganger større enn vannet, og frigjør veldig varme i begynnelsen. Hvis du har kontakt med dem, vender de den glatte huden, på grunn av forsømmelsen av hudens fettsyrer i huden.
Basicity (PKB)
- 0,56
Ph
En 5 % P/P -løsning i vann har en pH nær 14
Refraction Index (ND)
Ved en bølgelengde på 580,4 nm: 1,433 til 320 ºC, og 1 421 til 420 ° C.
Stabilitet
Beholderne som inneholder den, må være tett lukket for å forhindre dannelse av natriumkarbonat. Dette skyldes dens høye hygroskopisitet, som fører til at den absorberer fuktigheten i miljøet og dens samhold2.
Nedbrytning
Når det er oppvarmet til nedbrytning avgir en røyk fra natriumoksid.
Selvretningspunkt
Det er ikke brannfarlig
Goo
4,0 CPOISE ved 350 ºC
Fordampningsvarme
175 kJ/mol a 1.388 ºC
Overflatespenning
74,35 dynas/cm i en 2,72 % P/P -løsning i vann ved 18 ° C.
Reaktivitet
Med syrer
Reagerer med organiske og uorganiske mineralsyrer, forårsaker vann og tilsvarende salt. Når det gjelder svovelsyre, er reaksjonen eksotermisk.
Kan tjene deg: aluminiumsulfid (AL2S3): struktur, egenskaper, bruk2 NaOH+H2SW4 => Na2SW4 + 2 h2ENTEN
Med syreoksider
Reagerer med svoveldioksid, for eksempel å gi et salt av sulfitt og vann:
2 NaOH +så2 => Na2SW3 + H2ENTEN
Med metaller
Dens vandige oppløsninger reagerer med noen metaller for å forårsake komplekse natriumsalter. For eksempel gir reaksjonen hans med sink opphav til en natrium sinkato:
Zn + 2 NaOH + 2 H2O => na2[Zn (OH)4] + H2
Syntese
Natriumhydroksyd syntetiseres hovedsakelig ved to metoder: bruk av natriumkarbonat, opprinnelig brukt og natriumkloridelektrolyse, for tiden av større industriell bruk.
Natriumkarbonatreaksjon og kalsiumhydroksyd
Natriumkarbonat reagerer med kalsiumhydroksyd i en prosess kjent som kaustifisering:
CA (OH)2 + Na2Co3 => Caco3 + Naoh
Kalsiumkarbonat presipiterer, og etterlater natriumhydroksyd i supernatanten, som er konsentrert ved fordampning.
Natriumkarbonat kommer tidligere fra solvayprosessen:
2 NaCl+ Caco3 => Na2Co3 + Cacl2
Natriumkloridelektrolyse
Natriumkloridelektrolyse, til stede i saltlake, produserer hydrogengass, kloridgass og natriumhydroksyd i vandig løsning:
2 NaCl+2 H2O => h2 + Cl2 + 2 Naoh
Det elektrolytiske kammeret består av et rom der anoden (+), av titanmetall og sted der saltlaken er plassert. Dette rommet er atskilt fra katodekommen (-) ved bruk av en porøs membran.
Følgende reaksjon oppstår ved anoden:
2 Cl- => Cl2 + 2 e- (oksidasjon)
I mellomtiden forekommer denne reaksjonen i katoden:
2 h2O +2 e- => H2 + Åh- (reduksjon)
Natrium (na+) Diffus fra anoderommet til katoden, gjennom membranen som skiller dem, og danner natriumhydroksyd.
applikasjoner
Rengjøringsprodukter
Natriumhydroksyd brukes til fremstilling av såper og vaskemidler som brukes hjemme og i kommersiell aktivitet. Kombinasjonen av natrium og klorhydroksid produserer klorblekemiddel, brukt i hvite klærvask.
Det eliminerer også akkumulering av fett i avløpene, og produserer eliminering gjennom konvertering til såper gjennom forsidelsesprosessen. Dette tillater eliminering av hindring av husholdningsrør og andre bygninger.
Farmasøytiske og medisiner
Natriumhydroksyd brukes til utdyping av vanlige smertestillende midler, for eksempel aspirin. Også av medisiner med antikoagulantvirkning som blokkerer dannelsen av blodpropp og medisiner for å redusere hyperkolesterolemi.
Energiprosesser
Natriumhydroksyd brukes til fremstilling av brenselceller som fungerer som batterier for å produsere strøm for en rekke applikasjoner, inkludert transport. Epoksyharpikser, produsert med natriumhydroksydinngrep, brukes i vindmøller.
Det kan tjene deg: galvanisk korrosjon: mekanismer, eksempler, beskyttelseVannbehandling
Natriumhydroksyd brukes til å nøytralisere vannsyre og bidra til eliminering av tungmetaller i IT. Det brukes også til natriumhypoklorittproduksjon, et desinfeksjonsmiddel for vann.
Natriumhydroksyd reagerer med aluminiumsulfat for dannelse av aluminiumhydroksyd: flokkculant middel brukt i vannbehandlingsanlegg for å øke partikkelsedimentering, og produserer dens avklaring.
Papirproduksjon
Natriumhydroksyd brukes med natriumsulfid i behandlingen av tre for å oppnå cellulose, på en nesten ren måte, som danner basen av papiret. Det brukes også i resirkuleringen av papiret, siden det ved å skille blekket, lar det oss bruke det igjen.
Industriell produksjon
Natriumhydroksyd brukes til fremstilling av Rayón, spandex, eksplosiver, epoksyharpikser, glass og keramikk. Det brukes i tekstilindustrien for fargestoffer, og behandle bomullsstoffer.
I sukkerrørbehandlingsanlegg brukes natriumhydroksyd med lav temperatur for sukkerrør Bagazo -produksjon.
Risiko
Natriumhydroksyd er en svært etsende forbindelse, så det kan føre til kontakt med huden, forbrenninger, amponer og til og med permanente arr.
I kontakt med øynene kan det produsere alvorlige forbrenninger, hevelse, smerte, uskarpt syn og i alvorlige tilfeller kan det forårsake permanent blindhet.
Sodiumhydroksydinntak kan forårsake brannskader på leppene, tungen, halsen, spiserøret og magen. Blant de vanlige symptomene er kvalme, oppkast, magekramper og diaré manifestert.
Selv om natriumhydroksydinhalering er sjelden, og bare kan oppstå på grunn av tilstedeværelsen av sammensatt støv i luften eller ved dannelse av en dugg som inneholder det, produserer den en irritasjon i lungene.
I tilfelle av en kronisk eksponering, kan dette forårsake lungeødem og alvorlig pustforkortelse, noe som utgjør en medisinsk nødsituasjon.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Hydroksyd -natrium. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2019). Hydroksyd -natrium. PubChem -database. CID = 14798. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Amerikanske elementer. (2019). Natriumhydroksydoppløsning. Hentet fra: Amerikanementer.com
- Kjemiske sikkerhetsfakta. (2019). Hydroksyd -natrium. Gjenopprettet fra: ChemicalSafetyFacts.org
- NJ Health. (2015). Hydroksyd -natrium. [PDF]. Gjenopprettet fra: NJ.Gov
- Canadian Center for Occupational Health & Safety. (2019). OSH svarer faktaark: natriumhydroksid. Gjenopprettet fra: COHS.Ac
- Ausetute. (s.F.). Natriumhydroksyd og klorproduksjon ved elektrolyse. Gjenopprettet fra: ausetute.com.Au
- « Chol språk opprinnelse, egenskaper, hvor er du snakket, ord
- Indekserte magasiner Karakteristikker, kriterier, innflytelsesrike eksempler »

