Hydrofobe interaksjoner hva som er viktighet, eksempler
- 4079
- 1313
- Mathias Aas
De Hydrofobe interaksjoner (hei) De er kreftene som opprettholder samhold mellom apolare forbindelser nedsenket i en polar løsning eller løsningsmiddel. I motsetning til andre ikke-kovalente interaksjoner, for eksempel hydrogenbroer, ioniske interaksjoner eller van der Waals-krefter, er hydrofobe interaksjoner ikke avhengig av de iboende egenskapene til oppløsninger, men snarere av løsningsmidler.
Et veldig illustrerende eksempel på disse interaksjonene kan være faseseparasjonen som oppstår når det gjelder å blande vann med olje. I dette tilfellet samhandler oljemolekylene "med hverandre som et resultat av bestillingen av vannmolekylene rundt dem.
 Emulsjon av fett i vann (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons)
Emulsjon av fett i vann (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons) Forestillingen om disse interaksjonene eksisterer siden før førtiårene. Imidlertid ble begrepet "hydrofob link" myntet av Kauzmann i 1959, mens han studerte de viktigste faktorene i stabilisering av den tre -dimensjonale strukturen til visse proteiner.
Hans er de viktigste ikke -spesifikke interaksjonene som foregår i biologiske systemer. De har også en viktig rolle i en rekke tekniske applikasjoner og den kjemiske og farmasøytiske industrien som vi kjenner i dag.
Årsak til hydrofobe interaksjoner
Den fysiske årsaken til hans er basert på manglende evne til apolare stoffer for å danne hydrogenbindinger med vannmolekyler i en løsning.
De er kjent som "ikke -spesifikke interaksjoner" siden de ikke er relatert til affinitet mellom oppløste molekyler, men snarere med tendensen til vannmolekyler til å opprettholde sine egne interaksjoner ved hjelp av hydrogenbindinger.
Kan tjene deg: BiosurfaktanterVed kontakt med vann har apolare eller hydrofobe molekyler en tendens til å tilsette spontant, for å oppnå større stabilitet ved å redusere kontaktområdet med vann.
Denne effekten kan forveksles med en sterk attraksjon, men det er ikke annet enn en konsekvens av stoffets apolare karakter i forhold til løsningsmidlet.
Disse spontane assosiasjonene er forklart fra et termodynamisk synspunkt, og forekommer på jakt etter en energisk gunstig tilstand, der du har minst fri energivariasjon (∆G).
Tar i betraktning at ∆G = ∆H - T∆S, Den mest energisk gunstige tilstanden vil være den der entropi (∆S) Være større, det vil si hvor det er mindre vannmolekyler hvis rotasjons- og translasjonsfrihet reduseres ved kontakt med en apolar oppløsning.
Når apolare molekyler er assosiert med hverandre, tvunget av vannmolekyler, oppnås en gunstigere tilstand enn om disse molekylene forble atskilt, hver omgitt av et "bur" med forskjellige vannmolekyler.
Biologisk betydning
Hans har stor relevans, siden de forekommer i mangfold av biokjemiske prosesser.
Blant disse prosessene er de konformasjonsendringene i proteiner, foreningen av enzymsubstrater, assosiasjonen av underenheter av enzymatiske komplekser, aggregering og dannelse av biologiske membraner, stabilisering av proteiner i vandige oppløsninger og andre.
I kvantitative termer har forskjellige forfattere gitt oppgaven med å bestemme hva viktigheten av hans er i stabiliteten i strukturen til store mengder protein, og konkluderer med at disse interaksjonene bidrar til mer enn 50 %.
Det kan tjene deg: oksidase glukose: egenskaper, struktur, funksjonerMange membranproteiner (integrert og perifert) er assosiert med lipid -dobbeltlag takket være HI når disse proteiner i deres strukturer har hydrofobe domener. I tillegg avhenger stabiliteten i den tertiære strukturen til mange oppløselige proteiner av HI.
Noen teknikker i studiet av cellebiologi utnytter egenskapen som noen ioniske vaskemidler poster.
Miceller brukes også i farmasøytiske studier som involverer levering av fettoppløselige medisiner, og deres dannelse er også viktig for absorpsjon av komplekse vitaminer og lipider i menneskekroppen.
Eksempler på hydrofobe interaksjoner
Membraner
Et utmerket eksempel på HI er dannelsen av cellemembraner. Slike strukturer er sammensatt av et dobbeltlag av fosfolipider. Organisasjonen din blir takket være hans som oppstår mellom apolare haler i "frastøtning" til det omgivende vandige miljøet.
Proteiner
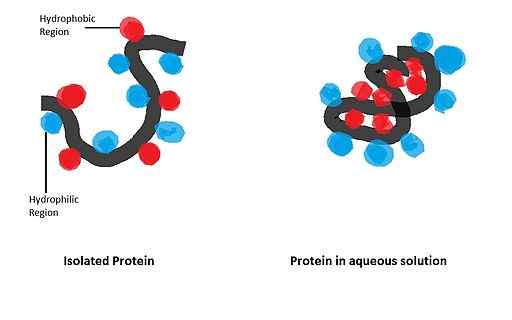
Hans har stor innflytelse på folding av kuleproteiner, hvis biologisk aktive form oppnås etter etablering av en bestemt romlig konfigurasjon, styrt av tilstedeværelsen av visse aminosyreavfall i strukturen.
- Tilfellet med apomioglobin
Apomicoglobin (myoglobin som mangler hemo-gruppen) er et lite alfa-helikoidalt protein som har tjent som en modell for å studere foldingsprosessen og viktigheten av hans blant apolar avfall i polypeptidkjeden av samme.
I en studie utført av Dyson og samarbeidspartnere i 2006 hvor muterte sekvenser av apomioglobin ble brukt, ble det vist at initieringen av de sammenleggbare hendelsene av dette først og fremst avhenger av Hans blant aminosyrer med apolare grupper av alfa-helices.
Det kan tjene deg: Forholdet mellom materie og energi observert i cellesnæringDermed betyr små endringer som er introdusert i aminosyresekvensen viktige modifikasjoner i tertiærstrukturen, noe som resulterer i dårlig dannede og inaktive proteiner.
Vaskemidler
Et annet tydelig eksempel på hans er virkemåten for kommersielle vaskemidler som vi bruker til innenlandske formål hver dag.
Vaskemidler er amfipatiske molekyler (med en polarregion og en annen apolar). De kan "emullere" fett siden de har evnen til å danne hydrogenbindinger med vannmolekyler og har hydrofobe interaksjoner med lipidene som er til stede i fett.
Ved kontakt med fett i en vandig oppløsning er vaskemiddelmolekylene assosiert med hverandre på en slik måte at de apolare halene vender mot, og omslutter lipidmolekylene, og blir utsatt for overflaten av mycela polare regionene, som går inn i vannkontakt.
Referanser
- Chandler, d. (2005). Grensesnitt og drivkraften til hydrofob montering. Natur, 437(7059), 640-647.
- Dyson, J. H., Wright, s. OG., & Sheraga, h. TIL. (2006). Rollen til hydrofobe interaksjoner i initiering og forplantning av proteinfolding. PNAs, 103(35), 13057-13061.

