Ritchter-Wenzel Law Hva er, historier, uttalelser, eksempler
- 1334
- 410
- Jonathan Moe
De Ritchter-Wenzel Law eller av gjensidige proporsjoner er en som slår fast at masseforholdene mellom to forbindelser tillater å bestemme den av en tredje forbindelse. Det er en av lovene om støkiometri, sammen med loven om Lavoisier (lov om bevaring av masse); Proust -loven (lov om de definerte proporsjonene); og Daltons lov (lov om flere proporsjoner).
Ritcher uttalte sin lov i 1792 i en bok som definerte grunnlaget for støkiometri, basert på forskningsarbeidet til Carl F Wenzel, som i 1777 publiserte det første ekvivalensbordet for syrer og baser.
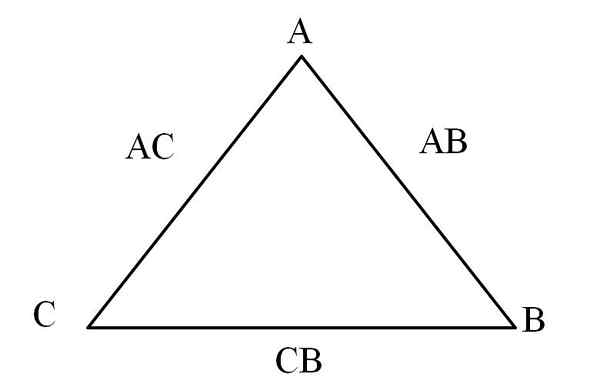
 Gjensidighetstrekant. Kilde: Gabriel Bolívar
Gjensidighetstrekant. Kilde: Gabriel Bolívar En enkel måte å visualisere det på er gjennom en "gjensidighetstrekant" (overlegen bilde). Hvis massene av A, C og B er kjent som er blandet for å danne AC- og AB -forbindelsene, kan det bestemmes hvor mye av C og B som er blandet eller reagert til å danne CB -forbindelsen.
I forbindelsene AC og AB er elementet A til stede i begge deler, så når du deler deres masseforhold er hvor mye C reagerer med B.
[TOC]
Historie og generaliteter i loven om gjensidige proporsjoner
Richter fant ut at vekt andelen av forbindelsene som konsumeres i en kjemisk reaksjon alltid er den samme.
I denne forbindelse fant Ritcher at 615 deler er påkrevd i vekt av magnesia (MGO), for eksempel for å nøytralisere 1000 deler etter vekt av svovelsyre.
Mellom 1792 og 1794 publiserte Ritcher et sammendrag av tre bind som inneholdt hans arbeid med loven om definerte proporsjoner. Sammendraget prøvde støkiometrien, og definerte den som kunsten å kjemiske målinger.
Kan tjene deg: Fin lagkromatografi: egenskaper, hva er det forPeker, i tillegg, at støkiometri omhandler lovene som stoffer er sammen med å danne forbindelser. Richters forskningsarbeid ble imidlertid kritisert for den matematiske behandlingen han brukte, og bemerket at han justerte resultatene.
I 1802 publiserte Ernst Gottfried Fischer den første tabellen over kjemiske ekvivalenter, som brukte svovelsyre med figuren på 1000; I likhet med verdien som Richter har funnet, for nøytralisering av svovelsyre av magnesia.
Imidlertid har det blitt påpekt at Richter bygde et bord med kombinasjonspesos som indikerer andelen der et antall forbindelser reagerte. For eksempel er det indikert at 859 NaOH -deler nøytraliserer 712 deler av HNO3.
Uttalelser og konsekvenser
Uttalelsen om Richter-Wenzels lov er som følger: massene av to forskjellige elementer som er kombinert med samme mengde av et tredje element, holder samme forhold som massene til disse elementene når de kombineres med hverandre.
Denne loven tillot å etablere den ekvivalente vekten, eller vekt-sjareregrammet, for eksempel mengden av et element eller forbindelse som vil reagere med en fast mengde av et referansestoff.
Richter kalt kombinasjonsvekter relatert til vektene til elementene som ble kombinert med hvert gram hydrogen. Richters relative kombinasjonsvekter tilsvarer det som for øyeblikket er kjent som tilsvarende vekt av elementene eller forbindelsene.
I samsvar med den forrige tilnærmingen kan Richter-Wenzels lov oppgis som følger:
Kombinasjonens vekter av forskjellige elementer som er kombinert med en vis.
Det kan tjene deg: metoder for separasjon av heterogene blandingerEksempler
Kalsiumklorid
I kalsiumoksyd (CaO) er 40 g kalsium kombinert med 16 g oksygen (O). I mellomtiden, i hypoklorisk oksid (CL2O), 71 g klor er kombinert med 16 g oksygen. Hvilken forbindelse ville kalsiumform hvis det kombineres med klor?
Ved å bruke gjensidighetstrekanten er oksygen det vanlige elementet for de to forbindelsene. Masseforholdene til de to oksygenerte forbindelsene bestemmes først:
40g Ca/16 GO = 5G CA/2G eller
71g Cl/16g eller
Og nå deler de to masseforholdene av CAO og CL2Eller vi vil ha:
(5g Ca/2g O)/(71g Cl/16g O) = 80g Ca/142g CL = 40g Ca/71G CL
Merk at loven om masseforhold er oppfylt: 40 g kalsium reagerer med 71 g klor.
Svoveloksider
Oksygen og svovel reagerer med kobber for å gi kobber (CUO) og kobbersulfid (CUS). Hvor mye svovel ville reagere med oksygen?
I kobberoksydet er 63,5 g kobber kombinert med 16 g oksygen. I kobbersulfid er 63,5 g kobber sammen med 32 g svovel. Deling av masseforholdene vi har:
(63,5g Cu/16G O)/(63,5g Cu/32g s) = 2032g S/1016G O = 2G S/1G eller
Masseandel 2: 1 er et multiplum av 4 (63,5/16), som viser at Richters lov er oppfylt. Med denne andelen oppnås SO, svovelmonoksid (32 g svovel reagerer med 16 g oksygen).
Hvis denne andelen er delt med to, vil det være 1: 1. Igjen, det er nå 4 eller 2, og derfor er det SO2, Svoveldioksid (32g svovel reagerer med 32 g oksygen).
Kan tjene deg: fucosa: egenskaper, struktur, funksjonerSulfid og jernoksyd
Jernsulfid (FES) reagerte, hvor 32 g svovel kombineres med 56 g jern, med jernholdig (stygt) oksid, der 16 g oksygen kombineres med 56 g jern. Dette elementet fungerer som en referanse.
Hos FES og stygge reagerende forbindelser finnes svovel (er) og oksygen (O) i forhold til jern (tro) i proporsjon 2: 1. I svovelholdig oksyd (SO) er 32 g svovel kombinert med 16 g oksygen, så svovel og oksygen finnes i proporsjon 2: 1.
Dette indikerer at loven om gjensidige proporsjoner eller lov om Richter er oppfylt.
Andelen som ble funnet mellom svovel og oksygen i svoveloksid (2: 1), kan for eksempel brukes til å beregne hvor mye oksygen reagerer med 15 g svovel.
o oksygen g = (15g s) ∙ (1g o/2g s) = 7,5g
Referanser
- Lov om gjensidig andel: Definisjon og eksempel. Studere. Gjenopprettet fra: Studie.com
- Lov om gjensidige proporsjoner. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org

