Radikaler leier hvordan de dannes, nomenklatur, eksempler

- 3318
- 217
- Prof. Theodor Gran
De Radikaler leier De er et sett med ustabile molekyler som stammer fra tap av hydrogener av en alkan. De er preget av å ha et forsvunnet elektron, så de reagerer raskt for å fullføre oktet av Valencia av atomet der det ligger.
Disse radikaler er symbolisert med bokstaven R, som leiegruppene, men med forskjellen som et poeng legges til, r ·. Dette punktet indikerer at tilstedeværelsen av et elektron forsvant. Tenk for eksempel metangass, cho4. Denne alkanen, som mister et av sine hydrogener, vil bli transformert til den radikale metylen, Cho3· (Bilde nedenfor).
 Generell formel for en radikal alkyl og den radikale metylen. Kilde: Gabriel Bolívar via Molview.
Generell formel for en radikal alkyl og den radikale metylen. Kilde: Gabriel Bolívar via Molview. Hvis du vil utdype litt om den radikale strukturen CH3· Det vil sees at det forsvant elektronet er i en vinkel vinkelrett på C-H-koblingene; det vil si at det ligger i en orbital p ren. Derfor Cho3· Vedta en SP -hybridisering2, så vel som generelt med andre radikaler.
Disse radikaler er hjørnesteinen i kjedereaksjonene der alkanene deltar, som tilfellet er deres halogenasjoner: klorering, bromasjon, etc. Det er 1., 2. og 3. radikaler, så vel som vinyl og alilic, hver med sin respektive stabilitet og enkel trening.
[TOC]
Hvordan dannes radikaler alkyl?
Den "enklere" reaksjonen som radikaler dannes for er halogenering av alkaner. For å danne, må kjedereaksjonen gis, som bare oppstår ved høye temperaturer (over 250 ºC), eller under forekomsten av ultrafiolett lys ved romtemperatur.
Kan tjene deg: natriumsulfitt (Na2SO3)Tenk på klorering av metan under en av forholdene som er nevnt ovenfor:
Cl2 → 2Cl ·
Energien som følger med er nok til å bryte CL-CL-koblingen til klormolekylet, som forekommer et homolitisk brudd; det vil si at hvert kloratom blir med en av koblingselektronene. Derfor dannes to radikaler.
Deretter angriper en radikal CL · et metanmolekyl:
Cl · + CH4 → HCl + CH3·
Og den radikale metylen vises. Denne kap3· Det er ganske ustabilt, så det vil reagere umiddelbart for å vinne et ekstra elektron som det vil vises med det ensomme elektronet:
Ch3· + Cl2 → Ch3Cl + Cl ·
Den dannede vil reagere med et annet metanmolekyl og syklusen vil bli gjentatt igjen og igjen. Når metan går tom, vil følgende reaksjoner oppstå som vil avslutte kjedereaksjonen:
CL · + · CL → CL2
Ch3· + · Cho3 → Ch3Ch3
Ch3· + · CL → CH3Cl
Relativ stabilitet
Ch3
Metan er ikke den eneste alkanen som er "radikalisert" ved klorering. Det skjer også det samme med etan, propan, butan og andre isomerer. Det som imidlertid varierer er den nødvendige energien som må gis slik at radikaler Cl · dehydrogat et molekyl av alkan. Når det gjelder metylradikalen, er den veldig ustabil og derfor vanskelig å danne.
Dermed den radikale Cho3Ch2· Det er mer stabilt og enkelt å danne enn Cho3·. Fordi? Fordi den radikale CH3Ch2· Det er primært, som betyr at det forsvinnede elektronet er på et karbonatom som er knyttet til et annet karbon. I mellomtiden, Cho3Så snart det er knyttet til hydrogenatomer.
Kan tjene deg: Fluor: Historie, egenskaper, struktur, innhenting, risiko, brukHva handler dette om? Husker den forrige representasjonen, er det forsvinnede elektronet lokalisert i en orbital p, vinkelrett på de andre koblingene. I kap3· Hydrogenatomer donerer knapt elektronisk tetthet til karbonatomet, i et forsøk på å kompensere for mangelen på et annet elektron.
1
I kap3Ch2· På den annen side er karbon med det forsvinnede elektronet knyttet til to hydrogener og en metylgruppe. Følgelig får dette karbonet større elektronisk tetthet, noe som hjelper til med å stabilisere elektronet forsvant litt. Den samme forklaringen er gyldig for andre første Alkynd -radikaler.
2
I en radikal sekundær eller 2. alquil, for eksempel isopropilradikalen, (CH3)2C. Derfor er den mer stabil enn 1. og metylradikaler.
3
Vi har også tertiære eller 3. alkyndradikaler, for eksempel Ter-Butyl Radical3)3C ·. Disse er mer stabile enn 1. og 2. Nå er det tre kullsyreholdige grupper som er forskjellige fra hydrogenatomet som stabiliserer det forsvinnede elektronet.
Allylic og vinyl
Det er også verdt å nevne de allyliske radikaler, Cho2= Ch-ch2·, Og vinyl, cho2= Ch ·.
Alilic er den mest stabile av alle. Dette er fordi det forsvinnede elektronet til og med er i stand til å bevege seg til karbonatomet i den andre enden. Vínilico er derimot den mest ustabile av alle, siden COS -gruppen2=, mer syre, tiltrekker seg elektronisk tetthet mot seg selv i stedet for å donere den mot karbon med elektronet forsvunnet.
Kan tjene deg: blyhydroksyd: struktur, egenskaper, bruksområder, risikoerOppsummert er den relative stabiliteten til alkyndradikaler, fra høyeste til laveste,:
Alilo> 3.> 2.> 1st> Vinyl
Nomenklatur
Nomenklaturen til radikalene Alkyl er den samme som for remedien. Dermed Cho3Ch2· Kalles etylradikal; og den radikale CH3Ch2Ch2Ch3, n-butyl.
Hovedradikaler leier
De viktigste alkylradikaler sammenfaller med alkylgrupper: de er de som har mindre enn seks karbonatomer. Derfor er radikalene avledet fra metan, etan, propan, butan og pentano, er de vanligste. På samme måte er den radikale vinylen og Alilicos en del av denne listen.
Andre alkyndradikaler som finnes sjeldnere er de som stammer fra cycloalcanos, for eksempel cyclobutane, cyclobutane eller cyclopentano.
I følgende bilde er flere av disse radikaler representert med tildelte bokstaver:
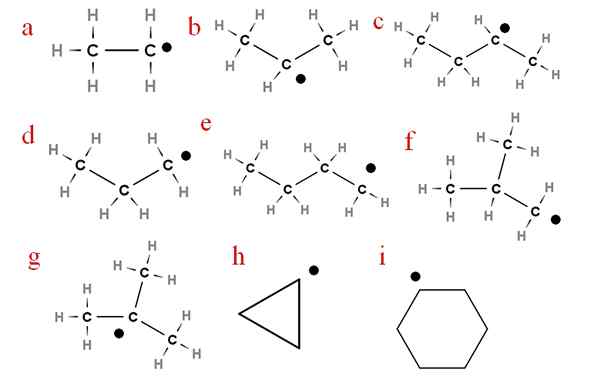 Ni av de viktigste Alchery -radikaler. Kilde: Gabriel Bolívar.
Ni av de viktigste Alchery -radikaler. Kilde: Gabriel Bolívar. Fra og med brevet 'A', har vi:
-A, etylradikal
-B, isopropylradikal
-C, Secbutyl Radical
-D, radikal propyl
-E, radikal n-butyl
-F, isobutil radikal
-G, ter-butylradikal
-H, radikal cycropilus
-Jeg, radikal cyclohexil
Hver av disse radikaler har kanskje ikke hydrogenene sine erstattet av andre grupper, så de er like varierte som alkaner og deres strukturelle isomerer.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10. utgave.). Wiley Plus.
- Wikipedia. (2020). Alkyl. Hentet fra: i.Wikipedia.org
- Kjemi librettexts. (5. juni 2019). Struktur av alkylradikaler: hyperkonjugering. Gjenopprettet fra: Chem.Librettexts.org
- « Kryssreferanser konsept, funksjoner, eksempler
- Akvatiske dyregenskaper, pusting, typer, eksempler »

