Reduksjon (kjemi)
- 1533
- 150
- Daniel Skuterud
 Sølvtre reduksjon. Kilde: Gabriel Bolívar
Sølvtre reduksjon. Kilde: Gabriel Bolívar Hva er reduksjonen?
De reduksjon Det er all den kjemiske reaksjonen der atomene til et av reagensene ender opp med å få elektroner, som også kan sees på denne måten: dens ledige stilling eller elektronisk "ubehag" reduseres. Et atom får elektroner når en art donerer dem, det vil si når oksiderer.
Denne typen reaksjoner kan ikke gis av seg selv: Hvis en art aksepterer elektroner, må en annen nødvendigvis gi dem. Ellers vil det bli skapt materie fra ingenting, og redusert atomer etter å ha fått tomme elektroner. Derfor er det en redox semi -lys (reduksjon/oksidasjon).
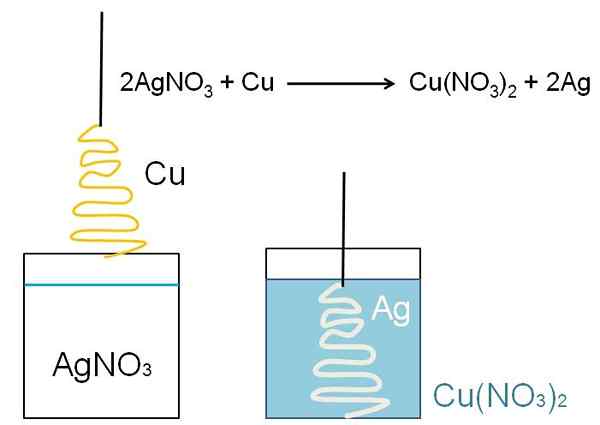
Et illustrerende eksempel på reduksjonen som kan vises i klasserommene i klassen er reaksjonen mellom en metallkobberoverflate, og en vandig sølvnitratoppløsning, Agno3.
I løsningen er sølv som kationer AG+, positivt lastet. Disse, når du samhandler med overflaten av kobberet, i form av juletreet, er elektronene hentet fra kobberatomer. Når dette skjer, erstatter kobber sølv i nitratsalt, og som et resultat dannes kobbernitrat, nei3)2.
Cu kationer2+ ved siden av nei3- De blåser løsningen, og sølvet legemliggjør juletreet som om de dekker det med snø.
Hva er reduksjonen?
I reduksjonen har det allerede blitt sagt at en art får elektroner. Hvordan kan dette sjekkes i en kjemisk ligning? For eksempel i reaksjonsligningen mellom Cu og Agno3, Hvordan vite når reduksjonen oppstår? For å bekrefte det, er det nødvendig å bestemme antall eller oksidasjonsstatus.
Kan tjene deg: elektronegativitetElementene har i sine naturlige tilstander som en definisjon en oksidasjonstilstand lik null, siden det antas at de ikke har mistet eller vunnet elektroner. Dermed har faste metaller null oksidasjonstilstand. Dermed passerer sølv fra +1 (AG+) A 0 (AG). Lasten til et metallion er lik oksidasjonstilstanden.
På den annen side kom elektronene fra kobber: flytting fra 0 (Cu) til +2 (Cu2+). Nitratanionen, nei3- forblir uforanderlig mens begge metaller utveksler elektroner. Derfor kan ligningen skrives som:
2ag+ + Cu => 2ag + cu2+
Merk at både belastninger og atomer er balanserte.
Dette består av den kjemiske reduksjonen: ved forsterkning av elektroner som gjør oksidasjonstilstandene til atomene at elektronene tjener mindre positive.
Antall oksygen
Oksygen er veldig elektronegativt og oksiderende atomer, så når en atomform komponert med dem (for eksempel oksider), har de positive oksidasjonstilstander. Jo større antall oksygen som samhandler med atomet, jo mer positiv vil oksidasjonen være. Eller hva som er det samme, er det mer oksidert.
Derfor, når en forbindelse har mindre oksygenatomer, sies det at den er mindre oksidert. Det vil si at atomet mister mindre elektroner.
Et klassisk eksempel kan sees i monoksid og karbondioksid. For CO har karbon en oksidasjonstilstand på +2, mens for CO₂ er oksidasjonsstatusen +4.
Så hvis CO₂ i en reaksjon blir transformert til CO, sies det at det skjer en reduksjon, siden karbonet nå samhandler med et oksygen og ikke to. For den motsatte reaksjonen, co -transformering, er det snakk om en oksidasjon av karbon.
Kan tjene deg: jernholdig klorid (FECL2): Struktur, bruksområder, egenskaperDette gjelder alle atomer, spesielt metaller i metalloksydene sine. For eksempel cro2 (Cr4+) og CRO3 (Cr6+).
I kjemiske ligninger, der en art mister oksygen mens den andre arten tjener det, sies det at en oksygenoverføring oppstår.
Elektronegativt atom
Det kan alltid bestemmes om det var en reduksjon ved å endre oksidasjonsstatus til en mindre positiv verdi. Som du nettopp forklarte, er en rask måte å legge merke til det på uten engang å gjøre beregningene å observere om det er en reduksjon i oksygenatomer i en forbindelse.
Det samme kan skje med ethvert annet atom som er mer elektronegativt enn atomet som vinner eller mister elektroner.
For eksempel, hvis CF4 reagerer på en slik måte at det blir cho4, Det sies da at en reduksjon skjedde, siden fluor er mye mer elektronegativt enn hydrogenatom. Som et resultat er karbon mindre oksidert i CHO4 Det i CF4, som er det samme for å si at det er redusert.
Eksempler
Reduksjon i organisk kjemi
Eksemplet på CF4 og Ch4 gjenspeiler det som skjer i organiske reaksjoner, der reduksjonen av delvis belastning av et atom anses som elektronisk forsterkning. Dette gjelder sterkt når man vurderer reduksjon av oksygenerte funksjonelle grupper.
Tenk for eksempel gruppene ROH, RCHO og COOH. Den første tilsvarer alkoholer, der karbon er knyttet til oksygen (C-OH); Den andre er aldehydgruppen, der karbon danner dobbeltbinding med oksygen og er også koblet til et hydrogen (C = O-H), og den tredje er karboksylgruppen.
Kan tjene deg: Berylhydroksid (BE (OH) 2)I karboksylgruppen danner karbon en dobbeltbinding med en O, og en enkel kobling med en annen O (ho-c = o).
Derfor oppstår en reduksjon hvis en karboksylsyre blir transformert til en alkohol:
RCOOH => ROH
Metallutvinning
Kjemisk reduksjon er ekstremt viktig i metallekstraksjonsprosesser fra sineralene. Noen av reaksjonene er:
HGS + O2 => Hg + så2
Kvikksølvsulfid reduseres til metallisk kvikksølv.
Cu2S + o2 => 2cu + så2
Kobbersulfid til metallisk kobber reduseres.
2ZNS + 3O2 => 2zno + 2SO2
ZnO + C => Zn + CO (legg merke til overføringen av O).
Sinksulfid reduseres først til monoksid og deretter til sin metalliske form.
Tro2ENTEN3 + 3CO => 2fe + 3CO2
Ferrisk oksyd reduseres til metalljern.
Wo3 + 3H2 => W + 3H2ENTEN
Og wolframtrioksid reduseres til metallisk wolfram.
Som en øvelse kan oksidasjonsnummeret til metallet bestemmes før det reduseres.
Andre eksempler
- Jernion (iii) kan reduseres til jern (II):
- Etino kan reduseres til Eteno:
- Etanal kan reduseres til etanol
Referanser
- Oksidasjonsreduksjonsreaksjoner. Chem kom seg.Librettexts.org.
- Definisjonen av reduksjon i kjemi. Gjenopprettet fra Thoughtco.com.




