Molar absorberende
- 3573
- 1121
- Thomas Karlsen
Hva er molar absorbering?
De Molar absorberende Det er en kjemisk egenskap som indikerer hvor mye lys som kan absorbere en art i løsning. Det vil si at det er en enhet som måler evnen til en løsning til å absorbere lys.
Ettersom lyset består av fotoner med energi (eller bølgelengder), avhengig av arten eller blandet blanding, kan et foton tas opp i større grad enn en annen. Betyr at lyset blir absorbert ved visse bølgelengder som er karakteristisk for stoffet.
Dermed er verdien av molar absorbitet direkte proporsjonal med graden av absorpsjon av lys til en viss bølgelengde. Hvis arten absorberer lite rødt lys, vil absorberingsverdien være lav. Hvis det er en uttalt absorpsjon av det røde lyset, vil absorbiteten ha en høy verdi.
En art som absorberer rødt lys vil gjenspeile en grønn farge. Hvis den grønne fargen er veldig intens og mørk, betyr det at det er en sterk absorpsjon av rødt lys.
Noen grønne nyanser kan imidlertid skyldes refleksene i forskjellige områder av gult og blått, som er blandet og oppfattet som turkis grønn, smaragd, glass, etc.
Molar absorberende ligning
Molar absorbitet er en konstant definert i det matematiske uttrykket av Lambert-Beer's lov, og påpeker ganske enkelt hvor mye lys som absorberer den kjemiske arten eller blandingen. Ligningen er:
A = εbc
Der A er absorbansen av løsningen på en valgt λ -bølgelengde, er B lengden på cellen der prøven som skal analyseres, er inneholdt, og derfor er det avstanden som lyset passerer i løsningen, C er konsentrasjon av den absorberende arten, og ε, molar absorberende.
Det kan tjene deg: AlquinosGitt λ, uttrykt i nanometer, forblir verdien av ε konstant konstant. Men ved å endre verdiene til λ, det vil si ved å måle absorbanser med lys av andre energier, ε endringer, når en minimum eller maksimal verdi.
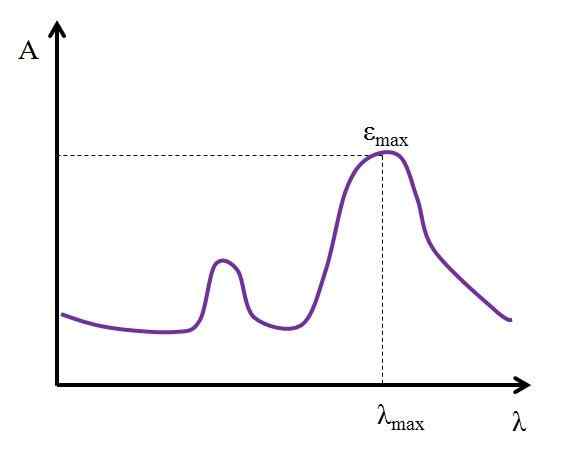
Hvis den maksimale verdien er kjent, εMaks, Det bestemmes samtidig λMaks. Det vil si lyset som mest absorberer arten:
 Graf der de maksimale lysabsorpsjonsverdiene til en kjemisk art vises. Kilde: Gabriel Bolívar
Graf der de maksimale lysabsorpsjonsverdiene til en kjemisk art vises. Kilde: Gabriel Bolívar Enheter
For å kjenne enhetene til ε, må vi vite at absorbanser er dimensjonsløse verdier, og derfor må multiplikasjonen av B- og C -enhetene annulleres.
Konsentrasjonen av den absorberende arten kan uttrykkes enten i g/l eller mol/l, og B uttrykker vanligvis i CM eller M (fordi det er lengden på cellen som krysser lysstrålen). Molaritet er lik mol/l, så C uttrykkes også som m.
Dermed oppnås å multiplisere B- og C -enhetene: M ∙ CM. Enhetene som ε må måtte etterlate verdien av a er de som ved å multiplisere.
Rydde deg, du er ganske enkelt oppnådd m-1∙ CM-1, som også kan skrives som: l ∙ mol-1∙ CM-1.
Bruk faktisk M -enheter-1∙ CM-1 eller l ∙ mol-1∙ CM-1 fremskynder beregningene for å bestemme molar absorbitet. Imidlertid uttrykkes det også vanligvis med M -enheter2/mol eller cm2/mol.
Når de kommer til uttrykk med disse enhetene, må noen konverteringsfaktorer brukes til å endre B- og C -enhetene.
Hvordan beregne molar absorbitet?
Direkte klaring
Molar absorbitet kan beregnes direkte ved å rydde i den forrige ligningen:
Kan tjene deg: syrer og baser i hverdagen: reaksjoner, bruksområder, eksemplerε = A/BC
Hvis konsentrasjonen av den absorberende arten er kjent, kan cellens lengde og hva som er absorbansen oppnådd ved en bølgelengde, beregnes ε. Imidlertid gir denne måten å beregne en unøyaktig og upålitelig verdi.
Grafisk metode
Hvis ligningen for Lambert-Beer's lov observeres nøye, vil det bemerkes at den ligner ligningen på en linje (y = ax+b).
Dette betyr at hvis A -aksverdiene er grafiske. Dermed ville det være y, x ville være c, og det vil være ekvivalent med εb.
Derfor, linjegrafen, bare ta to punkter for å bestemme skråningen, det vil si til. Når dette er gjort, og lengden på cellen, B, er det lett å fjerne verdien av ε.
I motsetning til direkte klaring, graf Vs. C lar deg gjennomsnittlig absorbansmålinger og redusere eksperimentell feil, og også gjennom et enkelt punkt kan de passere uendelig rett, så direkte klaring er ikke praktisk.
Eksperimentelle feil kan også gjøre at en linje ikke passerer to, tre eller flere punkter, så linjen oppnådd etter å ha påført minimum kvadratmetoden brukes faktisk (funksjon som allerede er integrert i kalkulatorene).
Alt dette forutsetter en høy linearitet, og derfor samsvar med Lamber-Beer's lov.
Løste øvelser
Oppgave 1
Det er kjent at en løsning av en organisk forbindelse med en konsentrasjon på 0.008739 M presenterte en absorbans på 0.6346, målt ved λ = 500 nm og med en celle på 0.5 cm lang. Beregn hva som er den molare absorberende av komplekset til nevnte bølgelengde.
Kan tjene deg: nikkel: historie, egenskaper, struktur, bruk, risikoFra disse dataene kan det tømmes direkte ε:
ε = 0.6346/(0.5 cm) (0.008739 m)
145.23 m-1∙ CM-1
Oppgave 2
Følgende absorbanser målt ved forskjellige konsentrasjoner av et metallisk kompleks med en bølgelengde på 460 nm, og med en 1 cm lang celle: lengde:
A: 0.03010 0.1033 0.1584 0.3961 0.8093
C: 1.8 ∙ 10-5 6 ∙ 10-5 9.2 ∙ 10-5 2.3 ∙ 10-4 5.6 ∙ 10-4
Beregn den molare absorbiteten til komplekset.
Det er totalt fem poeng. For å beregne ε er det nødvendig å tegne dem ved å plassere verdiene til a på Y -aksen. Når dette er gjort, bestemmes linjen for minimumsrutene, og med ligningen kan den bestemmes ε.
I dette tilfellet trukket punktene og trukket linjen med en bestemmelseskoeffisient r2 av 0.9905, er skråningen lik 7 ∙ 10-4, det vil si εb = 7 ∙ 10-4.
Derfor, med b = 1 cm, vil ε være 1428,57 m-1.CM-1 (1/7 ∙ 10-4).
Referanser
- Molar dempingskoeffisient. Innhentet fra.Wikipedia.org
- Science struct. Molar absorpsjon. Gjenopprettet fra Sciencestruck.com
- Kolorimetrisk analyse (Beer's Law eller Spectrophotometric Analysis). Chem kom seg.UCLA.Edu

