Acetanylide (C8H9NO)
- 4293
- 244
- Prof. Theodor Gran
Hva er acetanylid?
De Acetanylid (C8H9Nei) Det er en aromatisk amid som får flere ekstra navn: N-acetilarilamin, N-Feenilacetamid og atethanil. Det presenteres som et solid toalett i form av flak, dens kjemiske natur er Amida, og som sådan kan det danne brennbare gasser når den reagerer med sterke reduksjonsmidler.
I tillegg er det en svak base, å kunne reagere med dehydratiserende midler som P2ENTEN5 Å stamme en nitril. Det ble funnet at acetanylid hadde en smertestillende og antipyretisk handling, og ble brukt i 1886 med navnet Antifebrin av A. Cahn og p. Hepp.
I 1899 ble acetylsalisylsyre (aspirin) introdusert i markedet, som hadde de samme terapeutiske handlingene som acetanilid. Når bruk av acetanylid er relatert til utseendet til cyanose hos pasienter - en konsekvens av metemoglobinemi indusert av acetanylid - ble bruken kastet.
Deretter ble det fastslått at den smertestillende og antipyretiske virkningen av acetanylid var bosatt i en metabolitt av dette så -kalt paracetamol (acetoaminophen), som ikke hadde sine giftige effekter, som Axelrod og Brodie antydet.
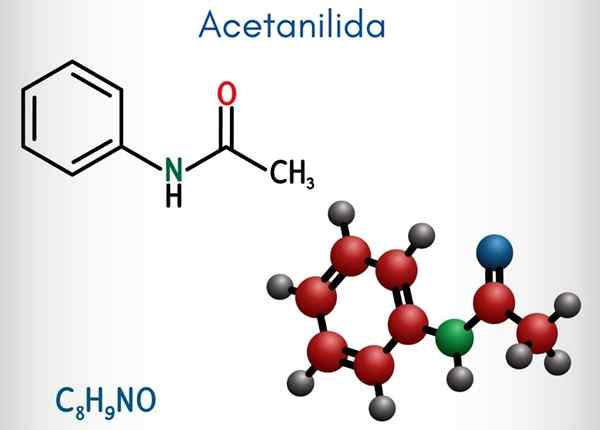
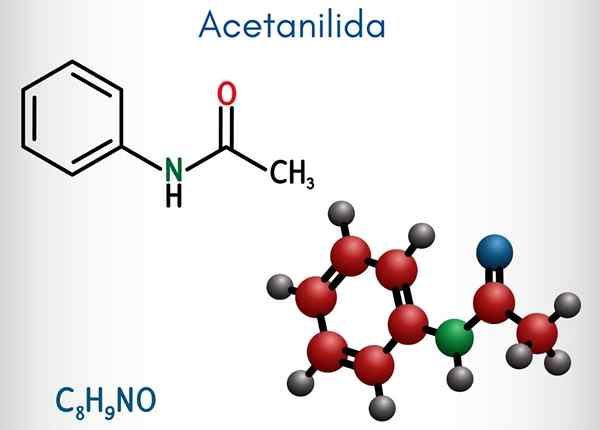
Kjemisk struktur

I det øvre bildet er den kjemiske strukturen til acetanylid representert. Til høyre er den sekskantede aromatiske ringen til benzen (med stiplede linjer), og venstre er grunnen til at forbindelsen består av en aromatisk amida: acetamidgruppen (Hncoch3).
Acetamidgruppen gir benzenringen en større polar karakter; Det vil si, skape et dipolmoment i atetanylide molekylet.
Fordi? Fordi nitrogen er mer elektronegativ enn noen av karbonatomene i ringen og også er knyttet til acylgruppen, hvis atom av eller også tiltrekker seg elektronisk tetthet.
Det kan tjene deg: uretan: struktur, egenskaper, innhenting, brukPå den annen side hviler nesten hele molekylstrukturen til acetanylid på samme plan på grunn av SP -hybridisering2 av atomene som komponerer det.
Det er et unntak knyttet til gruppen3, hvis hydrogenatomer utgjør toppunktene til en tetrahedron (de hvite kulene i venstre ende forlater flyet).
Resonansstrukturer og intermolekylære interaksjoner
Det ensomme dreiemomentet uten å dele i atomet i N sirkulerer gjennom π -systemet til den aromatiske ringen, og har sin opprinnelse flere resonansstrukturer. En av disse strukturene ender imidlertid med den negative belastningen i atomet av O (mer elektronegativ) og en positiv belastning i atomet til n.
Dermed er det resonansstrukturer der en negativ belastning beveger seg i ringen, og en annen der den ligger i atomet av eller. Som en konsekvens av denne "elektroniske asymmetrien"-som kommer fra hånden til molekylær asymmetri-, interagerer acetanylid intermolekylært av dipol-dipolo-krefter.
Imidlertid er hydrogenbroer-interaksjoner (N-H-O- ...) mellom to acetanylidmolekyler faktisk den dominerende kraften i dens krystallinske struktur.
På denne måten består acetanylidkrystaller av ortorrombiske enhetsceller av åtte molekyler orientert med former av "flate bånd" av deres hydrogenbroer.
Ovennevnte kan visualiseres hvis et acetanylidmolekyl er plassert på den andre, parallelt. Så som HNCOCH -grupper3 De overlapper hverandre, de danner hydrogenbroer.
I tillegg kan det mellom disse to molekylene også "bli stjålet" en tredjedel, men med sin aromatiske ring som peker mot motsatt side.
Kan tjene deg: Bromotimol BlueKjemiske egenskaper til Acetanylid
 Appealid utseende
Appealid utseende Molekylær vekt
135,166 g/mol.
Kjemisk beskrivelse
Hvitt eller gråaktig fast stoff. Danner lyse hvite flak eller et krystallinsk hvitt pulver.
Lukt
Toalett.
Smak
Litt krydret.
Kokepunkt
304 ºC til 760 mmHg (579 ºF ved 760 mmHg).
Smeltepunkt
114,3 ºC (237,7 ºF).
Blitz eller brennbarhet
169 ºC (337 ºF). Måling laget i åpent glass.
Tetthet
1.219 mg/ml ved 15 ° C (1.219 mg/ml ved 59 ºF)
Damptetthet
4.65 med luftforhold.
Damptrykk
1 mmHg ved 237 ºF, 1,22 × 10-3 mmHg ved 25 ºC, 2a ved 20 ° C.
Stabilitet
Det lider av en kjemisk omorganisering når den blir utsatt for ultrafiolett lys. Hvordan endres strukturen? Acetylgruppen danner nye koblinger i ringen i orto -posisjonene og for. I tillegg er det stabilt i luften og uforenlig med sterke oksidasjonsmidler, kaustikk og alkalier.
Volatilitet
Spesielt flyktig ved 95 ºC.
Selvretning
1004 ºF.
Nedbrytning
Den dekomponerer når den blir oppvarmet, og avgir en meget giftig røyk.
Ph
5 - 7 (10 g/l h2Eller 25 ºC)
Løselighet
- I vann: 6,93 × 103 mg/ml ved 25 ° C.
- 1 g Løselighet av acetanylid i forskjellige væsker: i 3,4 ml alkohol, 20 ml kokende vann, 3 ml metanol, 4 ml aceton, 0,6 ml kokende alkohol, 3,7 ml kloroform, 5 ml Gliecerol, 8 ml dioksan, 47 ml benzen og 18 eter. Klorhydrat øker løseligheten av acetanilid i vann.
Syntese
Det syntetiseres ved å reagere eddikanhydrid med acetanylid. Denne reaksjonen vises i mange organiske kjemitekster (Vogel, 1959):
C6H5NH2 + (Ch3Co)2O => c6H5NHCOCH3 + Ch3COOH
Det kan tjene deg: Borax: Historie, struktur, egenskaper, bruksområder, syntese, risikoapplikasjoner
- Det er et hemmermiddel for nedbrytningsprosessen for hydrogenperoksyd (hydrogenperoksyd).
- Stabiliser lakkene til celluloseester.
- Griper inn som en formidler i akselerasjonen av gummiproduksjon. På samme måte er det mellomledd i syntesen av noen fargestoffer og kamfer.
- Det fungerer som en forløper i syntesen av penicillin.
- Det brukes i produksjonen av 4-acetamidefonilbenzenklorid. Acetanylid reagerer med klorosulfonsyre (HSO3Cl), og produserer dermed kloridet til 4-aminosulfonilbenzen. Dette reagerer med ammonium eller et primært organisk amin for å danne sulfonamider.
- Den ble brukt eksperimentelt på det nittende århundre i utviklingen av fotografering.
- Acetanylid brukes som en markør for elektroosmotiske strømmer (EOF) i kapillærelektroforese for studiet av koblingen mellom medisiner og proteiner.
- Nylig har 1- (ω-fenoksialkiluracilo) sluttet seg til hemming i hemmingeksperimenter av hepatitt C-virusinhiberingseksperimenter. Acetanylid blir sammen med posisjon 3 i pyrimidinringen.
- Eksperimentelle resultater indikerer en reduksjon i replikasjonen av viralt genom, uavhengig av viral genotype.
- Før den identifiserte toksisiteten til acetanylid, ble den brukt som smertestillende og antipyretisk fra 1886. Deretter (1891) ble den brukt i behandlingen av kronisk og akutt bronkitt av Grün.