Etylacetat
- 1837
- 176
- Mathias Aas
Han etyl- eller etyletanacetat Det er en organisk forbindelse med kjemisk formel er Cho3Cooc2H5. Den består av en ester, der den alkoholholdige komponenten stammer fra etanol, mens dens karboksylsyrekomponent kommer fra eddiksyre.
Det er en væske under normal temperatur- og trykkforhold, og presenterer en aroma behagelig for frukt. Denne eiendommen kommer perfekt inn i harmoni, så den forventes av en ester; som faktisk er den kjemiske naturen til etylacetat. Av denne grunn finner han bruk i matprodukter og alkoholholdige drikker.
 Etylacetat. Kilde: Commons Wikimedia.
Etylacetat. Kilde: Commons Wikimedia. Det øvre bildet viser skjelettstrukturen til etylacetatoden. Legg merke til dens karboksylsyrekomponent, og til høyre er den alkoholholdige komponenten. Fra et strukturelt synspunkt kan denne forbindelsen forventes å oppføre seg som en hybrid mellom eddik og alkohol; Imidlertid viser den sine egne egenskaper.
Det er her slike hybrider kalt estere skiller seg ut for å være annerledes. Etylacetat kan ikke reagere som en syre, og heller ikke dehydrat ved fravær av en OH -gruppe. I stedet lider det grunnleggende hydrolyse i nærvær av en sterk base, for eksempel natriumhydroksyd, NaOH.
Denne hydrolysereaksjonen brukes i undervisningslaboratorier for kjemiske kinetikkeksperimenter; der reaksjonen, i tillegg, er andre ordre. Når hydrolyse oppstår, etils etanoat.
I sitt strukturelle skjelett observeres det at hydrogenatomer på oksygen dominerer. Dette påvirker dens evne til å samhandle med ikke så polare arter som fett. Det brukes også til å oppløse forbindelser som harpikser, fargestoffer og generelt organiske faste stoffer.
Til tross for at han har en hyggelig aroma, genererer en langvarig eksponering for denne væsken en negativ innvirkning (som nesten alle kjemiske forbindelser) på kroppen.
Etylacetatstruktur
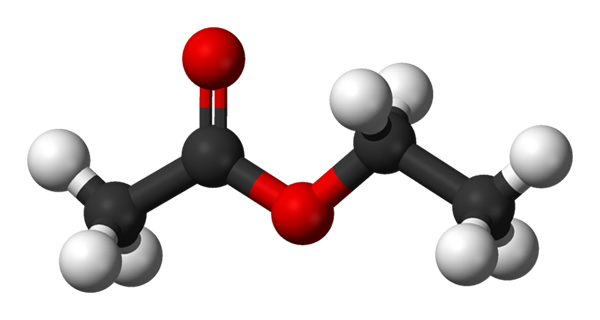
 Kuler og barer modell for etylacetat. Kilde: Benjah-BMM27 [Public Domain]
Kuler og barer modell for etylacetat. Kilde: Benjah-BMM27 [Public Domain] Det øvre bildet viser strukturen til etylacetatet med en modell av kuler og søyler. I denne modellen blir oksygenatomer med røde kuler fremhevet; Til venstre er fraksjonen avledet fra syre, og på høyre side er fraksjonen avledet fra alkohol (alcoxi, -eller).
Kan tjene deg: svake elektrolytter: konsept, egenskaper, eksemplerKarbonylgruppen kan sees av lenke C = O (de doble stolpene). Strukturen rundt denne gruppen og det tilstøtende oksygenet er flat, fordi det er en flytting av resonansbelastningen mellom begge oksygenene; faktum som forklarer en relativt lav surhet av α -hydrogener (de fra -ch -gruppen3, koblet til C = O).
Molekylet, som roterer to av koblingene, favoriserer direkte hvordan samhandler med andre molekyler. Tilstedeværelsen av de to oksygenatomer og asymmetri i strukturen, gir den et permanent dipolmoment; som igjen er ansvarlig for sine dipol-dipol-interaksjoner.
For eksempel er elektronisk tetthet større nær de to oksygenatomene, og synker betydelig i -CH -gruppen3, Og gradvis i OCH -gruppen2Ch3.
På grunn av disse interaksjonene danner etylacetatmolekyler en væske under normale forhold, som har et betydelig høyt kokepunkt (77 ºC).
Fravær av atomer Donorer av hydrogenbroer
Hvis strukturen blir nøye observert, vil fraværet av et atom som er i stand til å donere en hydrogenbro, bli lagt merke til. Imidlertid er oksygenatomer akseptorer av slikt, og etylacetat er veldig løselig i vann, og samhandler i en estimert grad med polare forbindelser og givere av hydrogenbroer (for eksempel sukker).
Det lar deg også samhandle utmerket med etanol; Årsaken til at tilstedeværelsen i alkoholholdige drikker ikke er overrasket.
På den annen side gjør hans alcoxi -gruppe ham i stand til å samhandle med visse apolare forbindelser, for eksempel kloroform, CH3Cl.
Fysiske og kjemiske egenskaper
Navn
-Etylacetat
-Etyletanoat
-Eddik etyl
-Acetoxietano
Molekylær formel
C4H8ENTEN2 eller Ch3Cooc2H5
Molekylær vekt
88.106 g/mol.
Fysisk beskrivelse
Klar fargeløs væske.
Farge
Fargeløs væske.
Lukt
Karakteristisk for eterne, lik lukten av ananas.
Smak
Hyggelig når den ble utvannet, bringer det en fruktsmak til øl.
Lukt terskel
3,9 ppm. 0,0196 mg/m3 (lav lukt); 665 mg/m3 (Høy lukt).
Kan tjene deg: kjemisk bindingForbeder lukt ved 7 - 50 ppm (gjennomsnitt = 8 ppm).
Kokepunkt
171 ºF ved 760 mmHg (77,1 ºC).
Smeltepunkt
-118,5 ºF (-83,8 ºC).
Vannløselighet
80 g/l.
Løselighet i organiske løsningsmidler
Blandelig med etanol og etyleter. Veldig løselig i aceton og benzen. Blandbar med kloroform, faste oljer og flyktige, og også med oksygenert og klorerte løsningsmidler.
Tetthet
0,9003 g/cm3.
Damptetthet
3.04 (i luftforhold: 1).
Stabilitet
Den dekomponerer sakte med fuktighet; uforenlig med flere sterke oksiderende plast og agenter. Blandingen med vann kan være eksplosiv.
Damptrykk
93,2 mmHg ved 25 ºC
Goo
0,423 MPOISE ved 25 ° C.
Forbrenningsvarme
2.238,1 kJ/mol.
Fordampningsvarme
35,60 kJ/mol ved 25 ºC.
Overflatespenning
24 dynas/cm ved 20 ºC.
Brytningsindeks
1.373 til 20 ºC/d.
Lager temperatur
2 - 8 ºC.
Pka
16 - 18 til 25 ºC.
Syntese
Fisherreaksjon
Etylacetat syntetiseres industrielt ved Fishers reaksjon, der etanol er esterifisert med eddiksyre. Reaksjonen gjøres ved romtemperatur.
Ch3Ch2Oh +Ch3COOH CH3Cooch2Ch3 + H2ENTEN
Reaksjonen akselereres ved syrekatalyse. Balansen beveger seg til høyre, det vil si mot produksjon av etylacetat, ved å fjerne vann; I henhold til masseaksjonsloven.
Tishchenko -reaksjon
Etylacetat tilberedes også industrielt ved bruk av Tishchenko -reaksjonen, og konjugerer to acetaldehydekvivalenter med bruk av en katalysator som katalysator.
2 Ch3Cho => cho3Cooch2Ch3
Andre metoder
-Etylacetat syntetiseres som et ko -produkt i oksidasjon av butan til eddiksyre, i en reaksjon gjort ved en temperatur på 175 ºC og 50 atm trykk. Det brukes som koboltkatalysator og kromioner.
-Etylacetat er et ko -produksjon av polyvinylpolyvinylacetatetanoly.
-Etylacetat produseres også i industrien ved dehydrogenering av etanol, katalyserer reaksjonen ved å bruke kobber ved høy temperatur, men mindre enn 250 ºC.
applikasjoner
Løsemiddel
Etylacetat brukes som et løsningsmiddel og fortynningsmiddel ved hjelp av rengjøring av kretskort. Det brukes som et løsningsmiddel i fremstilling av modifiserte humleekstrakt, og i koffeinholdige kaffe- og teblader. Det brukes i blekkene som brukes til å markere frukt og grønnsaker.
Det kan tjene deg: cyanhydronsyre: molekylstruktur, egenskaper, bruksområderEtylacetat brukes i tekstilindustrien som rensemiddel. Brukes i kalibreringen av termometre, brukt i sukkerseparasjon. I malingsindustrien brukes den som et løsningsmiddel og fortynningsmiddel av materialene som brukes.
Kunstige smaker
Det brukes til utdyping av fruktsmaker; For eksempel: banan, pære, fersken og ananas, samt druearoma, etc.
Analytics
Det brukes i bestemmelsen av vismut, bor, gull, molybden og platina, samt løsningsmiddel av talium. Etylacetat har evnen til å trekke ut mange forbindelser og elementer som er til stede i vandig løsning, for eksempel: fosfor, kobolt, wolfram og arsen.
Organisk syntese
Etylacetat brukes i bransjen som en reduksjon i viskositeten til harpikser som brukes i fotorestoningsformuleringer. Det brukes i acetamidproduksjon, acetylacetat og metylheptanon.
Kromatografi
I laboratorier brukes etylacetat som en mobil fase av kromatografier i søyler og som et ekstraksjonsløsningsmiddel. Å ha etylacetat et relativt lavt kokepunkt, det er lett å fordampes, noe som lar deg konsentrere de oppløste stoffene i løsningsmidlet.
Entomologi
Etylacetat brukes i entomologi for å kvele insektene som er plassert i en beholder, slik at dens samling og studie. Etylacetatdamp dreper insektet uten å ødelegge det og unngå deres herding, og lette innsamlingssamlingen deres.
Risiko
-LDfemti Fra etylacetat hos rotter indikerer det lav toksisitet. Imidlertid kan det irritere hud, øyne, hud, nese og hals.
-Eksponering for høye nivåer kan forårsake svimmelhet og besvimelse. På samme måte kan eksponering på lang sikt påvirke leveren og nyren.
-Etylacetatinhalering i en konsentrasjon på 20.000 - 43.000 ppm, kan produsere lungeødem og blødning.
-Arbeidsutstillingsgrensen er satt av OSHA ved 400 ppm i luften, i gjennomsnitt, i løpet av et 8 -timers arbeidsskifte.
Referanser
- Illustrert ordliste over organisk kjemi: ethylacetat (EtoAc). Gjenopprettet fra: Chem.UCLA.Edu
- Ethylacetat. Hentet fra: CHM.Bris.Ac.Storbritannia

