Aminer

- 2061
- 259
- Anders Mathisen
Hva er aminene?
De aminer De er organiske forbindelser avledet fra ammoniakk. I dem er det kovalente fagforeninger mellom karbon og nitrogen. Naturligvis er nitrogenmolekylet kinetisk inert; Men takket være biologisk fiksering blir det ammoniakk, som igjen lider påfølgende alkyleringsreaksjoner.
Når ammoniakk er "leid", erstatter den en, to eller tre av sine tre hydrogener med karbonatomer. Disse karbonatomer kan godt komme fra en leiegruppe (R) eller aryl (AR). Dermed er det alifatiske aminer (lineære eller forgrenede) og aromatisk.
Aminene er sterkere organiske baser enn samme ammoniakk. De er lett avtakbare fra plantestoff, og har generelt sterke interaksjoner med den neuronale matrisen av organismer; Derfor består mange medisiner og medisiner av aminer med komplekse strukturer og substituenter.
Aminstruktur
 Generell formel for en amin. Kilde: Mache, Wikimedia Commons.
Generell formel for en amin. Kilde: Mache, Wikimedia Commons. Selv om det varierer avhengig av arten av r, er det elektroniske miljøet til nitrogenatom det samme for dem alle: tetrahedral. Men med et par elektroner som ikke er delt på nitrogenatom (··), blir molekylærgeometrien pyramidal. Dette er slik med ammoniakk og aminer.
Aminas kan være representert med en tetrahedron, så vel som det gjøres med karbonforbindelser. Dermed NH3 og Ch4 De er tegnet som tetrahedra, der paret (··) er lokalisert i en av toppunktene over nitrogen.
Begge molekylene er akvirale; Imidlertid begynner de å presentere chiralitet når H erstatter. Amina r2NH er Aquiral hvis de to R er forskjellige. Imidlertid mangler det noen konfigurasjon for å skille en enantiomer fra en annen (som det skjer med de chirale karbonsentrene).
Dette er fordi enantiomerer:
R2N-H | H-nr2
De byttes ut med en hastighet slik at ingen av dem kan isoleres; og derfor regnes strukturene til aminerne som akviraler selv når alle substituenter i nitrogenatomet er forskjellige.
Aminegenskaper
Polaritet
Aminene er polare forbindelser, siden Amino NH -gruppen2, For å ha et atom av elektonegativt nitrogen, bidrar det til dipolmomentet til molekylet. Merk at nitrogen har kapasitet til å donere hydrogenbindinger, som generelt har høye kokende og fusjonspunkter.
Fysiske egenskaper
I kjemiens verden, når vi snakker om en amin, oppstår den ufrivillige handlingen med å dekke nesen hans. Dette er fordi de generelt sett har ubehagelige lukter, hvorav noen ser ut til den for råtten fisk.
Det kan tjene deg: Maillard -reaksjonI tillegg har flytende aminer vanligvis gulaktige nyanser, noe som øker den visuelle mistilliten de genererer.
Vannløselighet
Aminene har en tendens til å være uoppløselige i vann fordi til tross for at de er i stand til å danne hydrogenbroer med H₂O, er dens organiske komponent hydrofob. Jo mer klumpete eller lange R -gruppene, jo mindre vil løseligheten deres i vann være.
Når det er en syre i midten, økes løseligheten imidlertid ved dannelse av det som kalles aminsalter. I dem har nitrogen en positiv delvis belastning, som tiltrekker seg elektrostátisk til anionen eller syrekonjugatbasen.
Grunnleggende
Aminer er sterkere organiske baser enn ammoniakk. Jo større den elektroniske tettheten rundt nitrogenatomet, jo mer grunnleggende vil det være; det vil si at syrene i mediet vil bli raskere uprotonatet. Hvis aminet er veldig grunnleggende, kan den til og med snappe protonet fra alkoholene.
Typer (primær, sekundær, tertiær)
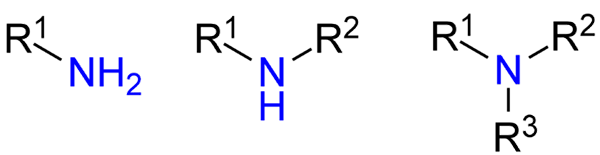 Typer aminer. Kilde: Jü via Wikipedia.
Typer aminer. Kilde: Jü via Wikipedia. Selv om de ikke er blitt presentert formelt, er det henvist til primære, sekundære og tertiære aminer (øvre bilde, fra venstre til høyre).
Primære aminer (RNH2) er monosustuidas; Sekundæren (r2NH), oppløses, med to R -alcomile eller arylgrupper; og tertiæren (r3N), er trisustuid og mangler hydrogen.
Alle eksisterende aminer er avledet fra disse tre typene, så deres mangfold og interaksjoner med den biologiske og neuronale matrisen er enorme.
Generelt kan tertiære aminer forventes å være de mest grunnleggende; En slik uttalelse kan imidlertid ikke komme med å vite strukturene til r.
Dannelse av aminer
Ammoniakkalkylering
Først ble det nevnt at aminer stammer fra ammoniakk; Derfor er den enkleste måten å danne dem gjennom deres alkylering. For å gjøre dette blir et overskudd av ammoniakk reagert med et alkylhalogenid, etterfulgt av tilsetning av en base for å nøytralisere aminsaltet:
NH3 + Rx => rnh3+X- => Rnh2
Merk at disse trinnene fører til en primær amina. Sekundære og til og med tertiære aminer kan også dannes, så ytelsen for et enkelt produkt avtar.
Noen treningsmetoder, for eksempel Gabriels syntese, tillater å få primære aminer slik at andre uønskede produkter ikke blir dannet.
Kan tjene deg: etylalkohol: struktur, egenskaper, bruk, skaffePå samme måte kan ketoner og aldehyder reduseres i nærvær av ammoniakk og primære aminer, for å gi opphav til sekundære og tertiære aminer.
Katalytisk hydrogenering
Nitroforbindelser kan reduseres i nærvær av hydrogen og en katalysator for å transformere til deres tilsvarende aminer.
Arno2 => Rnah2
Nitrilos, RC≡N og Amidas, RCONR2, De reduseres også for å gi henholdsvis primære og tertiære aminer.
Nomenklatur
Hvordan heter aminerne? Det meste av tiden er de navngitt i henhold til R, Aquilo eller Aryl Group. Til navnet R, avledet fra hans alkan, blir ordet 'amin' lagt til ham til slutt.
Dermed kap3Ch2Ch2NH2 Det er propilamin. På den annen side kan det bare utnevnes Alkane og ikke som en R -gruppe: Propanamin.
Den første måten å navngi dem på er like mye kjent og brukt på.
Når det er to NH -grupper2, Alkanen er utnevnt og stillingene til aminogruppene er oppført. Dermed h2Nch2Ch2Ch2Ch2NH2 Det kalles: 1,4-butanodiamin.
Hvis det er oksygenerte grupper, for eksempel å, bør NH prioriteres til NH2, som blir utnevnt som en substituent. For eksempel hoch2Ch2Ch2NH2 kalles: 3-aminopropanol.
Og med hensyn til sekundære og tertiære aminer, er N -bokstavene laget for å indikere R -gruppene. Den lengste kjeden vil holde navnet på forbindelsen. Dermed Cho3NHCH2Ch3 Det kalles: N-metyletylamin.
Bruk av aminer
Fargestoffer
Primære aromatiske aminer kan tjene som et startmateriale for syntese av Azo -fargestoffer. Opprinnelig reagerer aminerne på dannende diazoniumsalter, som danner forbindelsene med takopulering (eller diazoisk kobling).
På grunn av det intense av fargen, brukes de i tekstilindustrien som fargingsmateriale; For eksempel: Methyl Orange, Brown 138 Direct, Yellow Sunset FCF og Ponceau.
Narkotika og medikamenter
Mange medisiner virker med agonister og antagonister av naturlige amin -nevrotransmittere. Eksempler:
-Klorofeniramin er en antihistamin som brukes i kontrollen av allergiske prosesser på grunn av inntak av noe mat, høysnue, insektstikk, etc.
-Klorpromazin er et beroligende middel, ikke søvninduktor. Det lindrer angst og brukes til og med i behandlingen av noen psykiske lidelser.
-Efedrin og fenymfedrin brukes som dekongestanter i luftveiene.
Kan tjene deg: osmolaritet-Amitriptalin og imipramin er tertiære aminer som brukes i behandlingen av depresjon. Tricyclic antidepressiva er klassifisert etter strukturen.
-Opioide smertestillende midler som morfin, kodeline og heroin er tertiære aminer.
Gassbehandling
Flere aminer, inkludert diglycolamine (DGA) og dietolamin (DEA), brukes i eliminering av karbondioksidgasser (CO2) og hydrogensulfid (h2S) til stede i naturgass og raffinerier.
Landbrukskjemi
Metilaminer er mellomliggende forbindelser i syntesen av kjemikalier som brukes i landbruk som ugressmidler, soppdrepende midler, insektmidler og biocider.
Harpikserproduksjon
Metilaminer brukes under utdyping av ionebytterharpikser, brukbar i vann avionisering.
Dyrets næringsstoffer
Trimetylamin (TMA) brukes hovedsakelig til produksjon av kloridklorid, et vitamin B -tilskudd brukt i kyllinger, kalkuner og griser.
Gummiindustri
Dimetylamin (DMA) olje er en emulgator for bruk i syntetisk gummiproduksjon. DMA brukes direkte som en polymerisasjonsmodifiserer i dampfasen av butadien, og som en stabilisator av naturgummi -latexen i stedet for ammoniakk
Løsningsmidler
Dimetylamin (DMA) og monometylamin (MMA) brukes til å syntetisere timethylformamid polare polare løsningsmidler (DMF), dimetylacetamid (DMAC) og N-metylpirrolidon (NMP) (NMP).
Blant DMF -applikasjoner, inkluderer: uretanbelegg, akrylgarnoppløsningsmiddel, reaksjonsoppløsningsmidler og ekstraksjonsløsningsmidler.
DMAC brukes i fremstilling av fargestoffer og løsningsmiddel. Til slutt brukes NMP i raffinering av smøremiddeloljer, henting og emaljebelegg.
Eksempler på aminer
Kokain
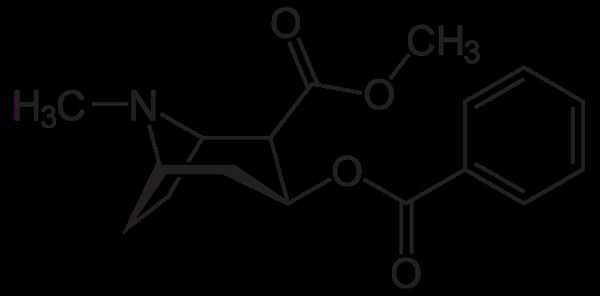 Kokainmolekyl. Neurotokeker, Wikimedia Commons
Kokainmolekyl. Neurotokeker, Wikimedia Commons Kokain brukes som lokalbedøvelse i visse typer øyekirurgi, ører og hals. Som sett er det en tertiær amin.
Nikotin
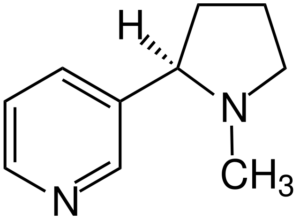 Nikotinmolekyl. Kilde: Jü [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons
Nikotinmolekyl. Kilde: Jü [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons Nikotin er det primære middelet for tobakksavhengighet og kjemisk en tertiær amin. Nikotinet som er til stede i tobakksrøyken, absorberes raskt og er svært giftig.
Morfin
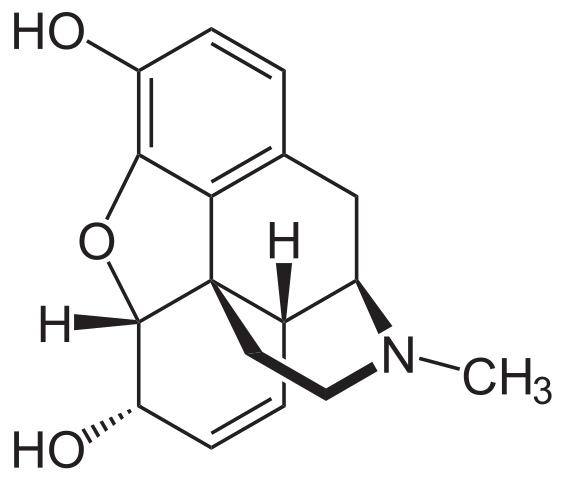 Morfinmolekyl. Kilde: Neurotoger [Public Domain], fra Wikimedia Commons
Morfinmolekyl. Kilde: Neurotoger [Public Domain], fra Wikimedia Commons Det er en av de mest effektive smertestillende midlene for å lindre smerter, spesielt kreft. Det er igjen en tertiær amin.
Serotonin
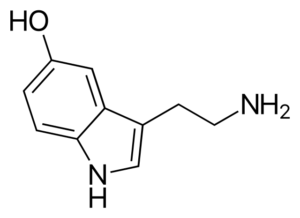 Serotoninmolekyl. Kilde: Harbin [Public Domain], fra Wikimedia Commons
Serotoninmolekyl. Kilde: Harbin [Public Domain], fra Wikimedia Commons Serotonin er en amin nevrotransmitter. Hos deprimerte pasienter reduseres konsentrasjonen av hovedmetabolitten av serotonin. I motsetning til de andre aminene, er dette primært.
Referanser
- Metylaminer: bruk og applikasjoner. Gjenopprettet fra: Chemours.com
- Transparens markedsundersøkelser. (s.F.). Amin: Viktige fakta og bruk. Gjenopprettet fra: gjennomsiktighetsmarkedsfør.com

