Elektronisk affinitet

- 1652
- 56
- Prof. Joakim Johansen
Hva er elektronisk affinitet?
De Elektronisk affinitet Det er definert som mengden energi som frigjøres når en mol atomer i gassformig tilstand kombineres med en mol elektroner for å danne en mol anioner, også i en gassformig tilstand. Med andre ord, det refererer til det negative av entalpi -variasjonen av følgende prosess:
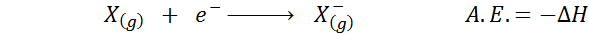
Som navnet tilsier, elektronisk affinitet (a.OG.) Det er et mål på trenden som har et atom å bli med i et elektron. Det vil si at det måler et atoms affinitet for elektroner.
Tolkning av elektronisk affinitet
På grunn av måten det er definert, innebærer en høy elektronisk affinitet at entalpi -variasjon er veldig negativ. Dette indikerer på sin side at prosessen er energisk gunstig og at produktene er mer stabile enn reagensene. Av denne grunn kan vi også si at elektronisk affinitet er et indirekte mål på stabiliteten til en anion.
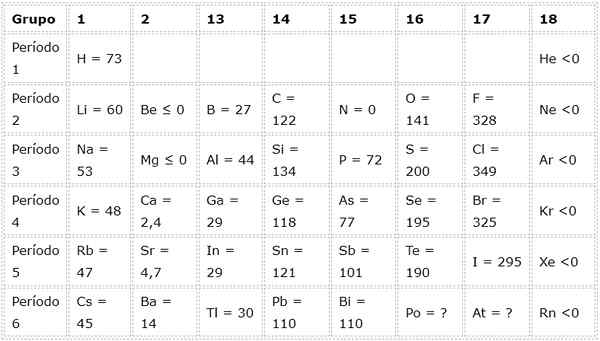
Jo større den elektroniske affiniteten til et atom, jo større er trenden for å danne anionen. Dette er grunnen til at atomer som klor, hvis elektronisk affinitet er 349 kJ/mol, har en tendens til å danne anioner lett (i dette tilfellet kloridanion), mens andre atomer som magnesium, hvis elektronisk affinitet er negativt, ikke danner anioner.
Avklaring om elektronisk affinitet og ioniseringsenergi
Mange ganger tenker du på elektronisk affinitet som det motsatte av ioniseringsenergi (tendensen til et gassformig atom til å miste et elektron), men dette er ikke slik. Tenk for eksempel et atom x.
Det kan tjene deg: Tusfrano: Kjemisk struktur, egenskaper og brukDens elektroniske affinitet refererer til endring av energi i prosessen vist ovenfor i den første ligningen. Imidlertid refererer dens ioniseringsenergi til energiforandring når atomet mister et elektron:
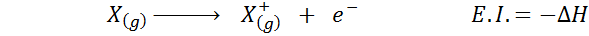
Selv om denne reaksjonen ser ut til å være den motsatte reaksjonen på den forrige.
Hva bestemmer elektronisk affinitet?
For å vite hvilke egenskaper ved et atom som påvirker verdien av dets elektroniske affinitet, må stabiliteten til det opprinnelige atomet vurderes, så vel som den for anionen som dannes. Hvis anionen er mer stabil enn atomet, vil den elektroniske affiniteten være høy, ellers vil den være lav eller til og med negativ.
Men hvordan du vet hvilken av de to artene som er mer stabil? For det er vi avhengige av to faktorer:
- Elektronisk konfigurasjon. Det er mer stabile elektroniske innstillinger enn andre. Generelt sett er hele lagkonfigurasjonen (som edelgasser) den mest stabile av alle. Deretter blir det fulgt av semi-Llena-lagkonfigurasjonen, der alle orbitalene i Valencia-laget har halvparten av elektronene de kunne ha (for eksempel 4S14p3).
- Elektronisk frastøtning. Hvis en belastningsanion -1 blir sammenlignet, med en lastanion -2, i det andre tilfellet vil det være mye mer frastøtning mellom elektroner, som destabiliserer anion.
Periodisk elektronisk affinitets tendens
 Graf som viser de elektroniske tilknytningene til de første 9 elementene i den periodiske tabellen
Graf som viser de elektroniske tilknytningene til de første 9 elementene i den periodiske tabellen Elektronisk affinitet er en av de periodiske egenskapene til elementene. Det vil si at det er en eiendom som varierer forutsigbart fra et element til et annet avhengig av sin posisjon i det periodiske tabellen. Generelt øker elektronisk affinitet når atomstørrelsen avtar.
Det kan tjene deg: semi -utviklet formel: hva er og eksempler (metan, propan, butan ...)I denne forstand varierer størrelsen på atomene avhengig av perioden og gruppen der den ligger i, så dens elektroniske affinitet varierer også som forklart nedenfor:
Variasjon av elektronisk affinitet over en periode
I det minste for de representative elementene (de som tilhører S- og P -blokkene i det periodiske tabellen), kan det observeres at den elektroniske affiniteten har en generell tendens til å øke fra venstre til høyre, på grunn av økningen i den effektive kjernefysiske belastningen som den som er i stand til å tiltrekke elektroner med større kraft.
For eksempel, hvis vi tar den tredje perioden av det periodiske tabellen, kan vi se at den elektroniske affiniteten til Li (60 kJ/mol) er mindre enn oksygen (141 kJ/mol) og dette er mindre enn fluoridet (328 kJ /mol).
Unntak
Den forrige regelen er ikke alltid oppfylt.
For det første, når du flytter fra alkaliske metaller til alkalinere, reduseres elektronisk affinitet. Dette er fordi for alkaliske metaller (NS elektronisk konfigurasjon1) Det er gunstig å fange et elektron, siden de ville fullføre å fylle orbital s.
I tilfelle av alkalineros (elektronisk konfigurasjon NS2) Å fange et elektron er ugunstig fordi de allerede har sin fulle orbital. Det samme skjer når du beveger deg fra halogener (som har de elektroniske tilknytningene til alle elementene) til edelgassene.
Variasjon av elektronisk affinitet i hele en gruppe
Når det gjelder grupper, er atferd enda mindre forutsigbar. Den generelle regelen er at a.OG. øker fra bunnen av, i samme retning som reduserer atomradius. For alkaliske og halogenmetaller blir denne regelen oppfylt ganske bra. Dette skjer imidlertid ikke med de fleste andre grupper.
Kan tjene deg: kobolthydroksidEksempler på elektronisk affinitet av noen representative elementer
Følgende tabell viser elektroniske affinitetsverdier i (kj/mol) av De representative elementene Sortert etter gruppe:
Nedenfor er noen eksempler på elektronisk affinitet sammen med reaksjonen de refererer til:
1. Hydrogen elektronisk affinitet
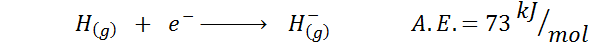
2. Elektronisk oksygenaffinitet
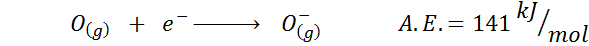
3. Anion elektronisk affinitet
Et annet vanlig eksempel er tilfellet med elektronisk affinitet til en anion som eller-. A-en.OG. I dette tilfellet er det gitt av energien forbundet med følgende prosess:
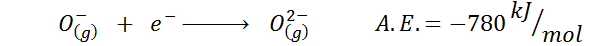
Som det kan sees, er denne elektroniske affiniteten sterkt negativ, selv om ionet eller2- Den har den elektroniske neonkonfigurasjonen (en edel gass) og å være et veldig vanlig ion i mange ioniske faste stoffer.
Årsaken er at frastøtningen av negative ladninger i OR2- destabiliserer denne gassformige tilstanden, men i fast tilstand er belastningen stabilisert av kationene som omgir den.

