Aufbau -prinsippet

- 1747
- 286
- Oliver Christiansen
 Atomic orbitals fyllingsrekkefølge i henhold til aufbau -prinsippet
Atomic orbitals fyllingsrekkefølge i henhold til aufbau -prinsippet Hva er Aufbau -prinsippet?
Han Aufbau -prinsippet, Også kjent som det regnfulle regelen eller konstruksjonsprinsippet, er det en praktisk regel som gjør det mulig å forutsi den elektroniske konfigurasjonen av det store flertallet av elementene i den periodiske tabellen, så vel som i dets ioner.
Dette prinsippet slår fast at når protoner blir lagt til kjernen, en etter en for å suksessivt bygge hvert kjemisk element, blir elektronene også lagt suksessivt til de minst energiske atomiske orbitaler som er tilgjengelige.
Med andre ord, Aufbau slo fast at det er en spesifikk rekkefølge etter hvilke atomiske orbitaler kan fylles. Denne ordren er forklart nedenfor.
Rekkefølgen på fylling av orbitalene i henhold til Aufbau -prinsippet
Rekkefølgen som atomiske orbitaler er fylt, avhenger av energinivået deres. Den gylne regelen er at disse energinivåene er fylt fra minst til størst, som om det var en bygning der leilighetene skulle fylles ut i de laveste etasjene for å få tilgang til de høyeste etasjene.
I denne forstand, for å forutsi rekkefølgen på fylling av orbitalene, må vi først vite hvordan de blir bestilt i henhold til energinivået. I bygningsanalogien betyr dette å vite hvilke (orbitale) leiligheter det er i hver etasje.
Følgende grafikk viser energinivået til de første atombanene bestilt fra laveste til større energi.
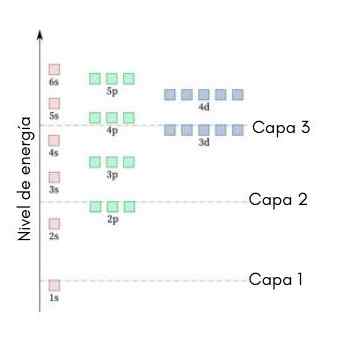
På dette bildet representerer hvert bilde en bestemt orbital der bare 2 elektroner passer. Hver gruppe malerier i samme farge representerer et undernivå av energi.
Disse underutstyrene er identifisert med et tall og et brev (1s, 3p, 3d, etc.). Antallet indikerer hovedenerginivået, mens bokstaven indikerer hvilken type orbital som danner gruppen.
Det kan tjene deg: aluminiumklorid (ALCL3)I følge denne ordningen er den første underutviklingen som må fylles ut 1s (minst mulig energi av alle), så kommer, 2S, 2P, 3S, 3P, 4S, 3D og så videre.
Regnregelen
Til tross for hvor enkelt det er å etablere rekkefølgen på fylling hvis du har en graf som den forrige, er det vanskelig å huske den spesielle ordren der de forskjellige underutstyrene går. For dette brukes det noen "regelen om regn".
Denne regelen består av to enkle trinn:
Trinn 1
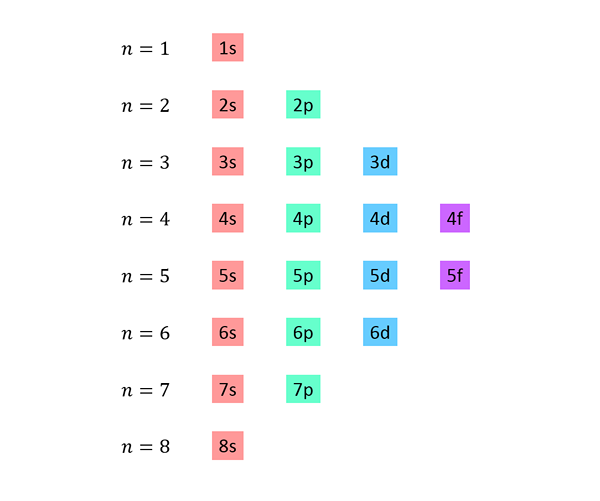
Det lages en liste der hver linje tilsvarer et energinivå, og inneholder den ene etter hverandre, alle underutstyr tilgjengelige på det energinivået.
For eksempel tilsvarer den første linjen nivå 1 (n = 1) og inneholder bare 1S undernivå; Den andre linjen tilsvarer nivå n = 2 og inneholder 2s og 2p undernivåer; Den tredje inneholder 3S, 3P og 3D -underutstyr, og så videre.
Den komplette listen ser slik ut:
Steg 2
Synkende diagonaler trekkes fra høyre til venstre, den ene under den andre, som vist nedenfor.
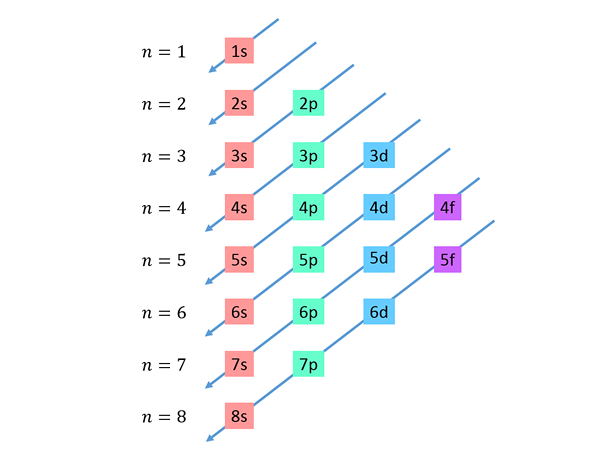
Disse linjene ligner vannets rute under en vind med vind, så denne grafen kalles vanligvis "regnmetoden". Fyllingsrekkefølgen bestemmes av rekkefølgen disse diagonalene berører underutstyrene på listen.
Basert på den forrige figuren, er ordens rekkefølgen av orbitalene, og derfor er rekkefølgen de må fylles ut:
Kan tjene deg: kvantbord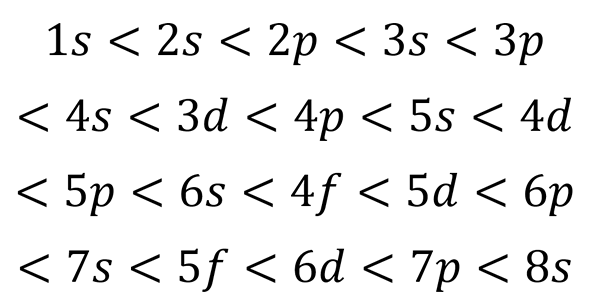
Denne fyllingsrekkefølgen er den eneste som virkelig betyr noe når du skriver den elektroniske konfigurasjonen av et atom. Når du fyller disse underutstyrene, må det huskes at i undernivåene s Bare 2 elektroner passer inn p passet 6, i d De passer 10 og i F De passer 14.
Unntak i begynnelsen av Aufbau
Aufbau -prinsippet fastslår tydelig at et underutvalg ikke kan fylles før alle tidligere underutstyr har fullstendig fylt. Imidlertid er det noen unntak fra denne regelen.
I noen tilfeller foretrekker atomet å ha et undernivå av energi fylt nøyaktig i to enn å ha en ufullstendig en som ikke er full i to. I disse tilfellene samsvarer ikke den faktiske elektroniske konfigurasjonen av atomet.
I følge Aufbau -prinsippet skal for eksempel kromatom ha en elektronisk konfigurasjon som ender i 4S2 3d4. Imidlertid er den virkelige konfigurasjonen 4S1 3d5 Siden dermed er 4S- og 3D -underutstyrene fylt i halvparten mens de er i den andre konfigurasjonen nei.
Det samme gjelder kobber hvis konfigurasjon ender i 4s1 3d10, i stedet for 4s2 3d9, Siden dermed fyller undernivå D og S er full i to.
Eksempler på anvendelsen av Aufbau -prinsippet
Deretter er det 5 eksempler på elementer som oppfyller Aufbau -prinsippet:
Eksempel 1: Natriumelektronisk konfigurasjon
Natrium er element 11, så det har 11 protoner og 11 elektroner. Den elektroniske konfigurasjonen er 1s2 2s2 2 s6 3s1.
Eksempel 2: Argon elektronisk konfigurasjon
Argon (AR) er element 18, så den har 18 protoner og 18 elektroner. Den elektroniske konfigurasjonen er derfor 1s2 2s2 2 s6 3s23p6. Det kan sees at hans undernivåer og P -undernivåer var helt.
Kan tjene deg: Propylen (C3H6)Eksempel 3: Elektronisk galliumkonfigurasjon
Gallium (GA) er element 31, så det har 31 protoner og 31 elektroner. Den elektroniske konfigurasjonen er 1s2 2s2 2 s6 3s23p64s23d104p1.
Dette kan skrives på en kortfattet måte som [AR] 4S23d104p1, Hvor [AR] representerer den elektroniske argonkonfigurasjonen presentert i forrige eksempel.
Eksempel 4: Elektronisk karbonkonfigurasjon
Karbon (c) er element 6, så det har 6 protoner og 6 elektroner. Den elektroniske konfigurasjonen er 1s2 2s2 2 s2.
Eksempel 5: Elektronisk klorkonfigurasjon
Klor (CL) er element 17. Dens 17 elektroner er distribuert i henhold til følgende elektroniske konfigurasjon: 1s2 2s2 2 s6 3s23p5 eller [ne] 3s23p5.
Ytterligere eksempler på unntak i begynnelsen av Aufbau
Deretter er det to ekstra eksempler på elementer som bryter Aufbau -prinsippet:
Eksempel 6: Molybden Electronic Configuration
Molybden (MO) er element 42. De første 36 elektronene er fordelt på samme måte som i kryptonen, men dets valenselektroner følger ikke normal orden. I stedet for å ha elektronisk konfigurasjon [KR] 5s24d4, Konfigurasjonen er [kr] 5s14d5, likt det som skjer med krom.
Eksempel 7: Sølvelektronisk konfigurasjon
La Plata (AG, Element 47) presenterer et brudd på Aufbau -prinsippet som ligner på kobber. Den elektroniske konfigurasjonen er [KR] 5s14d10 I stedet for [kr] 5s24d9.

