Etylalkoholstruktur, egenskaper, bruksområder
- 1285
- 81
- Prof. Joakim Johansen
Han Etylalkohol eller etanol Det er en organisk forbindelse hvis formel er c2H5Oh eller Ch3Ch2Å, presenterer seg som en fargeløs væske. Dette er den nest enkleste primære alkoholen av alle etter metanol. Det er veldig løselig i vann og i mange organiske løsningsmidler, noe som har tillatt utvikling av mange av bruksområdene.
Denne alkoholen har blitt brukt som antiseptisk og desinfeksjonsmiddel, i tillegg til bruken i syntesen av medisiner og andre organiske kjemikalier. Det har også blitt brukt som drivstoff i varmer, lamper, og i kombinasjon med bensin i motorvogner.

Fermentering av sukker for etanolproduksjon er en av de første kjemiske reaksjonene som den primitive mannen lærte. En 9000 år gammel keramikk er funnet i Kina.
Men gjæring av sukker produserte bare en veldig lav konsentrasjonsetanoloppløsning, og det var derfor det var nødvendig å lære destillasjonsteknikker for å eliminere vann og konsentrere alkohol. Dermed greske alkymister som jobbet i Alexandria på 1. århundre.C., De kjente og brukte destillasjon allerede.
Imidlertid er det syntetiske ruter som tillater å oppnå totalt ren etanol basert på etylen, som er destillert fra olje. Derfor er olje en indirekte kilde til etanol. På denne måten oppnås etanol eller absolutt alkohol.
[TOC]
Etylalkoholstruktur
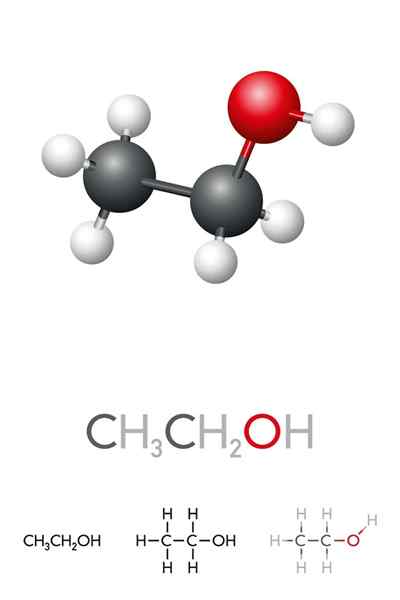
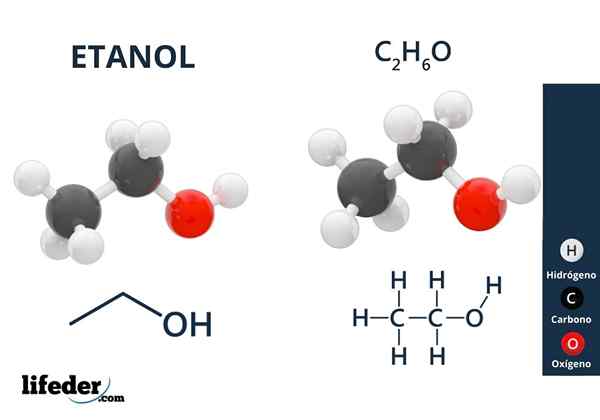
I det overlegne bildet har vi molekylstrukturen til etanol, Cho3-Ch2-Å, representert av en full rommodell. Det er en ganske polart molekylær, siden OH -gruppen tiltrekker seg elektronisk tetthet mot seg selv i karbonskjelettet som det er koblet til.
Som et resultat interagerer etylalkoholmolekyler gjennom dipol-dipol3Ch2Oh-ohch2Ch3. Det er grunnen til at denne alkoholen har et høyt kokepunkt sammenlignet med andre organiske løsningsmidler eller væsker.
Egenskaper
Fysisk utseende
Fargeløs væske.
Molmasse
46.069 g/mol
Lukt
Myk lukt og lik vin.
Smak
Brenne.
Tetthet
0.789 g/cm3 ved 20 ºC
Smeltepunkt
- 114.14 ºC
Kokepunkt
78,24 ºC
Vannløselighet
1 · 106 mg/l. Det vil si at det praktisk talt er blandbar i alle proporsjoner.
Blandbarhet med organiske løsningsmidler
Etanol er blandbar med eddiksyre, aceton, benzen, karbontetraklorid, kloroform, diety eter, etylenglykol, glyserol, pyridin og toluen. Det er også blandbar med lys alifatiske hydrokarboner, som Pentano og Hexano.
Oktanol/vannpartisjonskoeffisient
Logg P = - 0.31
Damptrykk
59.3 mm Hg ved 25 ºC. Derfor avskjediget en merkbar mengde damper.
Kan tjene deg: bariumklorid (BACL2)Damptetthet
1.59 i luftforhold tatt som enhet (1)
tenningspunkt
13 ºC
Selvordemperatur
363 ºC
Forbrenningsvarme
1336.8 kJ/mol a 25 ºC
Forbrenning
Etanol er en flyktig væske som brenner med en blå flamme, uten røyk, og som praktisk talt er usynlig for naturlig lys.
Spesifikk varme
0.618 kalk/g ved 23 ° C
Goo
1.2 MPa · s ved 20 ºC
Refraction Index ηd
1.3611
Bruk av etylalkohol
 En av de vanligste bruken av alkohol er som antiseptisk middel
En av de vanligste bruken av alkohol er som antiseptisk middel Medisinsk bruk
Antiseptisk middel
Etanol brukes som et antiseptisk middel, siden det har en dødelig virkning mot bakterier og sopp. Den er i stand til å endre strukturen i plasmamembranene, som gir dens ødeleggelse gjennom de osmotiske vannstrømmene som er etablert.
På samme måte kan etanol ødelegge mange typer virus. For tiden anbefales bruk av geler som inneholder alkohol for å desinfisere hendene og redusere smitte med koronavirus. Etanol brukes også til desinfisering av overfladiske mindre sår.
Medikamentoppløsningsmiddel
Mange medisiner er lite oppløselige i vann, og bruker etanol for å øke løseligheten. Noen spener for hoste og munnskyllinger har en etanol contempid på opptil 25%.
Smertebehandling
Etanol brukes til terapeutisk lysis av nerver eller ganglier for lettelse av kroniske utøvelige smerter, til stede i inoperabel kreft eller i en trigeminal nevralgi.
Symptomatisk behandling av skjoldbruskkjertelen
Perkutane etanolinjeksjoner brukes i behandlingen av cyster i skjoldbruskkjertelen, en enkel prosedyre som kan unngå komplikasjoner av kirurgisk inngrep.
Beroligende handling
Noen ganger administreres etanol intravenøst for preoperativ og postoperativ sedasjon, hos de pasientene som andre tiltak ikke er brukbare.
Motgift
Etanol brukes systemisk for behandling av forgiftning med metanol eller etylenglykol.
Glaukom
Etanol brukes til å redusere intraokulært trykk hos glaukompasienter.
Brensel
USA, sammen med Brasil, bruker 90% av etanol som brukes som drivstoff i biler. USA er den største kornprodusenten i verden, så den bruker mais som en kilde til etanol som drivstoff.
Regjeringen subsidierte maisdyrkere, som økte mellom 1979 og 1986 produksjonen av drivstoffetanol på 20 millioner gallon per år til 750 millioner liter.
Sukkerrør er den viktigste kilden til etanol i Brasil for bruk som drivstoff. I 1943, på grunn av andre verdenskrig.
Kan tjene deg: DeuteriumSiden 1976 har de blitt brukt som drivstoff i bilblandinger av etanol og bensin, hvis etanolinnhold varierer mellom 10 og 25 %, avhengig av sukkerrørproduksjon.
Fritidsbruk
Etanol er til stede i mange drinker som brukes i sosiale møter og til og med under lunsj- og familiemiddagen.
Den første virkningen av alkohol for å desinhere den sosiale atferden til personen produserer et hyggelig og tilretteleggende miljø i samspillet mellom mennesker. Imidlertid kan overflødig etanol detonere giftige og uønskede effekter på personlig helse og i harmoni mellom møter eller hendelser.
Personlig pleie
Etanol er til stede i mange kosmetikk- og skjønnhetsprodukter. I tillegg, på grunn av sin snerpende handling, brukes den i hudrensing, og eliminerer fett og skittent at vann og såpe ikke gjør det. Det er også en del av utarbeidelsen av mange kremer og parfymer.
Mat
Essensen av vanilje, en smak av bruk i kaker og kaker, blir oppløst i en blanding av etanol og vann. Godterier som er fylt med visse alkoholholdige drikker, selges. Alkohol brukes også som en smak av noen søtsaker.
Skaffer seg etylalkohol
Etanol oppnås hovedsakelig ved sukkerfermentering og etylenhydrering, og øver for å produsere den fra karbondioksid, lipider og cellulose.
Gjæring
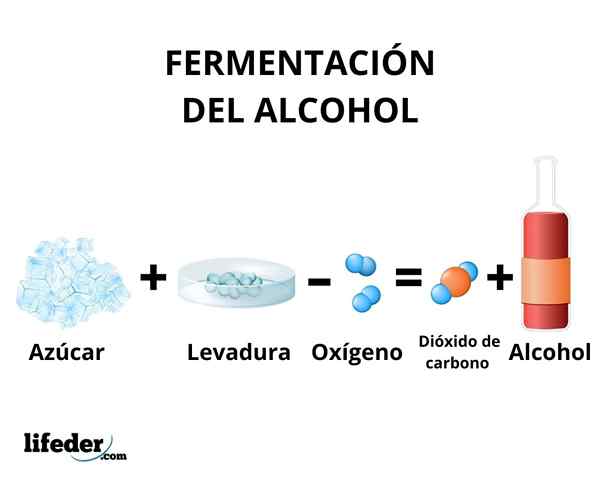
I gjæringsprosessen skjer transformasjonen av karbohydrater i etanol ved virkningen av enzymer som er til stede i gjæren. Hovedsakelig brukes sukkerrør, rødbeter og frokostblandinger som mais og bygg som råstoff.
Enzymene i glykolysen av noen gjærarter, for eksempel Saccharomyces cerevisiae, De er i stand til å handle på glukose og sukrose sukker, for å produsere etanol. Konsentrasjonen av etanol produsert er begrenset av følsomheten til gjær for etanol.
I alle fall overstiger ikke konsentrasjonen av etanol produsert ved gjæring ikke 18%. Det er nødvendig å konsentrere etanolløsningen ved hjelp av enkel destillasjon. Gjennom denne metoden oppnås en etanoloppløsning med en konsentrasjon rundt 95%.
Til slutt brukes fraksjonert destillasjon og 95% alkoholdehydrering for absolutt alkoholproduksjon. Etanol produsert ved gjæring brukes i medisin, og er reservert som et drivstoff som kompletterer bensin.
Etylenhydrering
I denne prosessen blandes etylen med høye temperaturer med avionisert damp ved høye temperaturer, mellom 250 og 300 ° C, og under et trykk på 6.8 MPa. Konvertering av etylen til etanol blir katalysert av fosforsyre plassert på en silisiumdioksyd eller diatomer.
Kan tjene deg: Mekaniske egenskaper til metallerEtylenhydratiseringsreaksjon kan skjematiseres som følger:
C2H4 + H2O → Ch3Ch2Åh
En del av fosforsyre blir dratt av vanndamp og bør nøytraliseres med fortynnet natriumhydroksyd. Konsentrasjonen av etanol oppnådd ved etylenhydrering er lav, med en verdi mellom 10 og 25%.
Deretter konsentreres etanoloppløsningen ved destillasjon, og oppnår en 95% etanoloppløsning, som kan utføres 100% ved fraksjonell destillasjon og dehydrering.
Andre metoder
Fra alternative metoder for etanolproduksjon har vi bruk av karbondioksid, lipider og cellulose. Bruken av cellulose er mer lovende, siden materialer som tre, halm, avfallspapirer osv., som en kilde til cellulose råstoff. Cellulose er en glukosepolymer og kan brukes som kilde til dette karbohydratet.
Toksisitet og risiko
 Hjemmelagde alkoholbåter finnes vanligvis i en konsentrasjon på 70%-90%
Hjemmelagde alkoholbåter finnes vanligvis i en konsentrasjon på 70%-90% Innånding
Høye konsentrasjoner av etanoldamp kan forårsake døsighet, irritasjon av øyne og øvre luftveier, manifestert av hoste og hodepine.
Direkte kontakt med hud og øyne
Hudkontakt kan forårsake tørrhet og kronisk, irritasjon og dermatitt. I mellomtiden produserer øyekontakt irritasjon, rødhet, smerte og brennende følelse.
Inntak
Produserer en brennende sensasjon og til å begynne med har den en stimulerende og behagelig handling på grunn av den produserte disinhibisjonen. Men når alkoholinntaket fortsetter, er det en nervedepresjon, hodepine, uskarpt syn, døsighet og bevisstløshet.
Kroniske effekter
Etanol påvirker sentralnervesystemet og øvre luftveier. I tillegg kan leverskadene forårsaket av inntak av etanol føre til skrumplever og deretter død, død.
Referanser
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10th Utgave.). Wiley Plus.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Etanol. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2020). Etanol. Pubchem Comunund sammendrag for CID 702. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Etanolhistorie. (2011). Etanolhistorie - fra alkohol til bil drivstoff. Gjenopprettet fra: Etanolhistory.com
- Redaktørene av Enyclopaedia Britannica. (2020). Etanol. Gjenopprettet fra: Britannica.com
- Korquiven. (15. oktober 2000). Sikkerhetsark (MSDS) Etylalkohol. [PDF]. Gjenopprettet fra: IIO.Ens.UABC.MX
- Byju's. (2020). Bruk av metanol og etanol. Gjenopprettet fra: Byjus.com
- Helmestine, Anne Marie, PH.D. (25. august 2020). Forskjellen mellom alkohol og etanol. Gjenopprettet fra: Thoughtco.com

