Alkoholer
- 2111
- 449
- Magnus Sander Berntsen
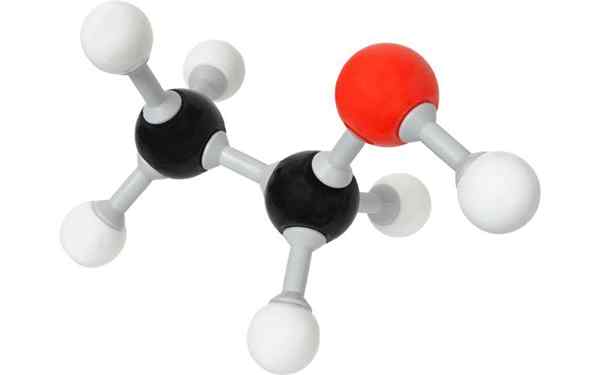
 Etanolmolekyl, eller etylalkohol. Med lisens
Etanolmolekyl, eller etylalkohol. Med lisens Hva er alkoholer?
De Alkoholer De er organiske forbindelser som er preget av å ha en hydroksylgruppe (-OH) knyttet til et mettet karbon, det vil si et karbon som er knyttet til fire atomer med enkle bindinger (uten doble eller trippelkoblinger).
Den generiske formelen for denne enorme og allsidige forbindelsesfamilien er ROH. For å bli betraktet som alkohol i en strengt kjemisk forstand, må OH -gruppen være den mest reaktive av molekylstrukturen. Dette er viktig å bekrefte, blant flere molekyler med OH -grupper, som av dem er en alkohol.
En av alkoholene par excellence og den mest kjente i populærkulturen er etylalkohol, eller etanol, CH3Ch2Åh. Avhengig av deres naturlige opprinnelse, og derfor av deres kjemiske miljø, kan blandingene deres forårsake et ubegrenset spekter av smaker, noen, som til og med viser positive endringer i ganen med løpet av årene.
Alkoholstruktur
Alkoholene har en generell ROH -formel. OH -gruppen er knyttet til den alquiliske gruppen, hvis struktur varierer fra en alkohol til en annen. Unionen mellom R og OH er en enkel kovalent lenke, R-OH.
Følgende bilde viser tre generiske strukturer for alkoholer, med tanke på at karbonatomet er mettet, det vil si at det danner fire enkle koblinger.
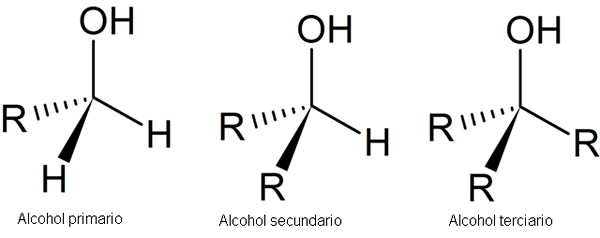 Alkoholstruktur. Kilde: Secalinum, Wikimedia Commons
Alkoholstruktur. Kilde: Secalinum, Wikimedia Commons Som det kan sees, kan R være hvilken som helst kullsyreholdig struktur så lenge den ikke har mer reaktive substituenter enn OH -gruppen.
Når det gjelder primær alkohol, er OH -gruppen knyttet til et primært karbon. Dette verifiseres lett ved å observere at atomet i midten av venstre tetrahedron er knyttet til en R og to H.
Sekundær alkohol, 2. plass, blir bekreftet med karbonet i tetrahedronen i senteret som nå er knyttet til to R -grupper og en H.
Og til slutt har du tertiær alkohol, 3., med karbon knyttet til tre R -grupper.
Amphifile karakter
Avhengig av typen karbon knyttet til OH, har du klassifiseringen av primære, sekundære og tertiære alkoholer. I Tetrahedra var de strukturelle forskjellene mellom dem allerede detaljerte. Men alle alkoholer, uavhengig av struktur, deler noe til felles: Amfifilkarakteren.
Det er ikke nødvendig å adressere en struktur for å legge merke til den, men det er nok med sin Roh kjemiske formel. Leiegruppen er nesten helt konstituert.
På den annen side kan OH -gruppen danne hydrogenbroer med vannmolekylene, og er derfor hydrofyl, det vil si at den presenterer en affinitet for vann. Deretter har alkoholer et hydrofobt skjelett, sammen med en hydrofil gruppe. De er apolare og polare samtidig, noe som er det samme som å si at de er amfifile stoffer.
Kan tjene deg: Forskjeller mellom homogene blandinger og heterogene blandingerR-oh
(Hydrofob) - (hydrofil)
Som det vil bli forklart i neste avsnitt, definerer amfifilkarakteren til alkoholer noen av deres kjemiske egenskaper.
Struktur av r
Renta r -gruppen kan ha noen struktur, og likevel er det viktig siden det lar alkoholene klassifiseres.
For eksempel kan R være en åpen kjede, som tilfellet er med etanol eller propanol, forgrenet, for eksempel T-butylalkohol (CH3)2Chch2Å, det kan være syklisk, som for cyclohexanol, eller kan ha en aromatisk ring, som i benzylalkohol (C6H5) Ch2Å, eller i 3-fenilpropanol (C6H5) Ch2Ch2Ch2Åh.
R-kjeden kan til og med ha substituenter som halogener eller dobbeltbindinger, for eksempel for alkoholer 2-celler og 2-bunt-1-ol (CH3Ch2= Chch2ÅH).
Tatt i betraktning strukturen til R, blir klassifiseringen av alkoholer kompleks. Derfor er klassifiseringen basert på dens struktur (1., 2. og 3. alkoholer) enklere, men mindre spesifikk, selv om det er tilstrekkelig å forklare reaktiviteten til alkoholer.
Fysiske og kjemiske egenskaper
- Kokepunkt: En av hovedegenskapene til alkoholer er at de er assosiert gjennom hydrogenbroer. Takket være dette er alkoholer vanligvis flytende med høye kokepunkter.
- Løsemiddelkapasitet: I hjem er det veldig vanlig å ty til bruk av isopropylalkohol for å fjerne en flekk som er vanskelig å fjerne på en overflate. Denne løsningsmiddelkapasiteten, veldig nyttig for kjemisk syntese, skyldes dens amfropifil -karakter, tidligere forklart. Fett er preget av å være hydrofob: det er derfor det er vanskelig å fjerne dem med vann. I motsetning til vann, har alkoholer imidlertid en hydrofob del i strukturen. Dermed samhandler gruppen Renta r med fett, mens OH -gruppen danner hydrogenbroer med vann, og hjelper til.
- Anfoterisme: Alkoholer kan reagere som syrer og baser, det vil si at de er amfotente stoffer. Dette er representert med følgende to kjemiske ligninger:
ROH + H+ => ROH2+
ROH + OH- => Ro-
RO- Det er den generelle formelen for det som er kjent som et alcoxide.
Nomenklatur
Det er to måter å navngi alkoholer på, hvis kompleksitet vil avhenge av deres struktur.
Vanlig navn
Alkoholer kan kalles for deres vanlige navn. For å gjøre dette, må navnet på R -gruppen være kjent, som avslutningen -iko blir lagt til, og er gitt av ordet 'alkohol'. For eksempel Cho3Ch2Ch2Å er propylico alkohol.
Kan tjene deg: heterogent systemAndre eksempler er:
- Ch3Å: metylalkohol.
- (Ch3)2Chch2Å: isobutylalkohol.
- (Ch3)3COH: Tert-Boutyl-alkohol.
IUPAC -system
Når det gjelder vanlige navn, må du begynne med å identifisere r. Fordelen med dette systemet er at det er mye mer presis enn det andre.
A, som det er et karbonskjelett, kan det ha konsekvenser eller flere kjeder. Den lengste kjeden, det vil si med flere karbonatomer, er som alkoholens navn vil bli tildelt.
Navnet på den lengste kjeden legges til navnet på alkanen, er avslutningen 'L' lagt til. Det er derfor Cho3Ch2Å kalles etanol (Cho3Ch2- + ÅH).
Generelt må oh ha minst mulig oppregning. For eksempel BRCH2Ch2Ch2(Å) Cho3 Det kalles 4-Bromo-2-butanol, og ikke 1-Bromo-3-butanol.
Syntese
Alkenes hydrering
Oljekraseringsprosessen produserer en blanding av fire eller fem karbonatomer, som lett kan skille seg.
Disse alkenene kan bli alkoholer ved direkte tilsetning av vann eller ved reaksjonen av alken med svovelsyre, etterfulgt av tilsetning av vannet som syren splitter, og har sin opprinnelse alkohol.
OXO -prosess
I nærvær av en tilstrekkelig katalysator reagerer alkener med karbon og hydrogenmonoksid for å generere aldehyder. Aldehydos kan lett reduseres til alkoholer ved en katalytisk hydrogeneringsreaksjon.
Det er ofte en slik synkronisering av OXO -prosessen at reduksjonen av aldehydos er nesten samtidig med deres dannelse.
Den mest brukte katalysatoren er decobalto octocarbonil, oppnådd ved reaksjonen mellom kobolt og karbonmonoksid.
Karbohydratfermentering
Karbohydratfermentering for gjær er fremdeles av stor betydning i produksjonen av etanol og andre alkoholer. Sukker kommer fra sukkerrør eller stivelse oppnådd fra forskjellige korn. Av denne grunn kalles etanol også "kornalkohol"
applikasjoner
Drinker
- Selv om det ikke er hovedfunksjonen til alkoholer, er tilstedeværelsen av etanol i noen av drinkene en av de mest populære kunnskapene. Dermed etanol, produkt av gjæring av sukkerrør, druer, eple osv., Det er til stede i mange sosiale forbruksdrikker.
Kjemisk råstoff
- Metanol brukes i formaldehydproduksjon, gjennom dens katalytiske oksidasjon. Formaldehyd brukes til produksjon av plast, malerier, tekstiler, eksplosiver, etc.
- Butanol brukes i produksjonen av Butanoat Butane, en ester som brukes som en smakstilsetning i matindustrien og konfekt.
- Allyicalkohol brukes til produksjon av estere, inkludert Dialilos ftalat og Dialilo Istalate, som fungerer som monomerer.
- Fenol brukes i harpikserproduksjon, nylonproduksjon, deodoranter, kosmetikk, etc.
- Lineære kjedealkoholer av 11-16 karbonatomer brukes som mellommenn for å oppnå myknere. For eksempel polyvinylklorid.
- De så -kallede fete alkoholene brukes som mellommenn i syntesen av vaskemidler.
Løsningsmidler
- Metanol brukes som en malingsløsningsmiddel, samt 1-butanol og isobutil alkohol.
- Etylalkohol brukes som et løsningsmiddel av mange uoppløselige forbindelser i vannet, og bruker som et løsningsmiddel i malerier, kosmetikk, etc.
- Fettalkoholer brukes som løsningsmidler i tekstilindustrien, i fargestoffer, i vaskemidler og i malerier. Isobutanol brukes som et løsningsmiddel i beleggmateriale, malerier og lim.
Drivstoff
- Metanol brukes som drivstoff i interne og additive bensinmotorer for å forbedre forbrenningen.
- Etylalkohol brukes i kombinasjon med fossilt brensel i motorvogner. For det formål er omfattende regioner i Brasil beregnet på dyrking av sukkerrør for etylalkoholproduksjon. Denne alkoholen har fordelen av å produsere i sin forbrenning bare karbondioksid. Når etylalkohol blir brent, produserer den en ren og røykfri flamme, og det er derfor den brukes som et drivstoff i kampanjekjøkken.
- Gelifisert alkohol produseres ved kombinasjon av metanol eller etanol med kalsiumacetat. Denne alkoholen brukes som en varmekilde i kampanjeovner, og når den søler, er den tryggere enn flytende alkoholer.
- Den så -kalt biobutanol brukes som transportdrivstoff, i tillegg til isopropylisk alkohol, selv om bruken ikke anbefales.
Antiseptika
- 70% konsentrasjon Isopropylalkohol brukes som et eksternt antiseptisk middel for eliminering av bakterier og retardasjon av dens vekst, akkurat som etylalkohol.
Andre bruksområder
- Cyclohexanol og metylciclohexanol brukes i tekstilfinishen, møbler behandlet og chitamanchas.
Eksempler på alkoholer og deres formler
- Metanol (kap3ÅH).
- 1-propanol (c3H7ÅH).
- Etanol (c2H5ÅH).
- Isobutanol (ca4H9ÅH).
- Isopropanol (c3H8ENTEN).
- Allilisk alkohol (C3H6ENTEN).
- Benzylalkohol (C7H8ENTEN).
- Termisk (c₄h₁₀o).
- Pentenol (ca5HelleveÅH).
- 2-butanol (kap3-Ch2-Choh-ch3).
- Fenol (c6H6ENTEN).
- 2-propanol (kap3-Choh-ch3).
- Isodecanol (ca10H21ÅH).
- Cetylalkohol (C16H3. 4ENTEN).
- Propargilal alkohol (C3H4ENTEN).
- Tetrahydrofuilisk alkohol (C5H10ENTEN2).
- Cyclohexanol (ca6H12ENTEN).
- 2-klorotanol (ca2H5CLO).
- Heptanol (ca7H16ENTEN).
- Hexanol (C₆h₁₄o).
Referanser
- Organisk kjemi. Mc Graw Hill.
- Alkoholer. Hentet fra Colapret.CM.UTEXAS.Edu.

