Alosterisme generelle aspekter, funksjoner og eksempler

- 2651
- 170
- Mathias Aas
Han Alosterisme o Strekkregulering er definert som prosessen med hemming eller aktivering av et enzym mediert av et regulatorisk molekyl forskjellig fra dets underlag og virker på et bestemt sted for strukturen, forskjellig fra det aktive stedet med samme.
Begrepet "alosterisk" eller "alosterisme" kommer fra de greske røttene "Allos ", som betyr "en annen" og "Stereós", som betyr "form" eller "sted"; Så bokstavelig talt oversettes som "annet rom", "et annet sted" eller "en annen struktur".
 Grafisk ordning med en til teosterisk regulering. (A) Aktivt nettsted. (B) Alosterisk sted. (C) Substrat. (D) Inhibitor. (E) enzym. (Kilde: Isaac Webb [CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons)
Grafisk ordning med en til teosterisk regulering. (A) Aktivt nettsted. (B) Alosterisk sted. (C) Substrat. (D) Inhibitor. (E) enzym. (Kilde: Isaac Webb [CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons) Noen forfattere beskriver alosterisme som en prosess der eksterne steder i et system (for eksempel strukturen til et enzym, er energisk koblet for å produsere en funksjonell respons, og det er derfor det kan antas at en endring i en region kan påvirke enhver annen i den samme.
Denne typen reguleringer er typisk for enzymene som deltar i flere kjente biologiske prosesser, for eksempel signaloverføring, metabolisme (anabolisme og katabolisme), regulering av genetisk uttrykk, blant andre.
De første ideene om alosterisme og deres deltakelse i kontrollen av cellulær metabolisme ble postulert på 1960 -tallet av f. Monod, f. Jacob og J. Changeux, mens du studerte de biosyntetiske rutene til forskjellige aminosyrer, som ble hemmet etter akkumulering av sluttproduktene.
Selv om den første publikasjonen i denne forbindelse hadde å gjøre med genetisk regulering, utvidet kort tid senere Monod, Wyman og Changeux unnfangelsen av alosterisme til proteiner med enzymatisk aktivitet og foreslo en modell basert på multimeriske proteiner, hovedsakelig støttet av interaksjoner mellom underenheter når noen av disse ble med en effektor.
Kan tjene deg: Guanina: Kjennetegn, struktur, trening og funksjonerMange av de påfølgende konseptene hadde sitt grunnlag i teorien om "indusert justering" som ble introdusert av Koshland noen år før.
[TOC]
Generelle funksjoner
Generelt har alle enzymer to forskjellige steder for ligandforening: det ene er kjent som det aktive stedet, som forbinder molekylene som fungerer som et underlag (ansvarlig for den biologiske aktiviteten til enzymet), og den andre er den andre kjenner som teosterisk Nettsted, som er spesifikt for andre metabolitter.
Disse "andre metabolitter" kalles alestheriske effektorer og kan ha positive eller negative effekter på reaksjonshastigheten katalysert av enzymer eller i affiniteten som de går sammen med underlagene sine på det aktive stedet.
Vanligvis forårsaker foreningen av en effektor på AL, et enzymsted en effekt på et annet sted for strukturen, og endrer dens aktivitet eller funksjonelle ytelse.
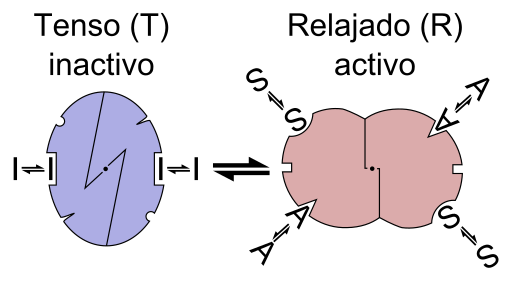 Grafisk skjema for reaksjonen av et enzym alosterica (Kilde: Fil: enzym allosteri er.PNG: Fil: enzym allosteri.PNG: Allostery.PNG: Nicolas Le Novere (snakk).Lenov på i.Wikipediaderivative Work: TimVickers (Talk) Derivat Work: Retama (Talk) Derivat Work: KES47 [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0) via Wikimedia Commons)
Grafisk skjema for reaksjonen av et enzym alosterica (Kilde: Fil: enzym allosteri er.PNG: Fil: enzym allosteri.PNG: Allostery.PNG: Nicolas Le Novere (snakk).Lenov på i.Wikipediaderivative Work: TimVickers (Talk) Derivat Work: Retama (Talk) Derivat Work: KES47 [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0) via Wikimedia Commons) Med andre ord, foreningen av en alestro -effektor til dets spesifikke sted i strukturen til et enzym forårsaker en endring i molekylær geometri av enzymet, som er kjent som overgangen til teosterisk, det vil si at det er en hendelse som overføres Gjennom makromolekylet, endre oppførselen.
Alosterisme kan være homotropisk eller heterotropisk. En homotropisk alostroisk reguleringsprosess er definert som den der det samme underlaget til et enzym fungerer som dets alestriske regulator, det vil si at den alosteriske effektoren er det samme underlaget; Det er også kjent som en type kooperativ.
En heterotropisk reguleringsprosess refererer derimot til regulering av aktiviteten til et enzym mediert av et molekyl eller effektor av teosterisk som er forskjellig fra dets underlag, og kan også ha positive eller negative effekter på aktiviteten til enzymet.
Det kan tjene deg: Aptenia cordifolia: Kjennetegn, habitat, egenskaper, dyrkingFunksjoner
Alosterisme, sammen med regulering av genetisk uttrykk, oversettelse og proteinnedbrytning, er en av de grunnleggende mekanismene for regulering av et stort antall organiske prosesser, noe som er essensielt for å opprettholde homeostase og for å overleve alle levende, encellulære eller multicellulære vesener.
Den toostale reguleringen eller alosterismen gir levende organismer evnen til å svare med stor følsomhet for endringer i konsentrasjonen av regulatoriske ligander, så vel som for opprinnelige rytmiske fenomener på cellulært nivå.
Siden energi og metabolske underlag er endelige i en celle, tillater alosterisme, i det metabolske feltet, moderat bruk av ressurser, og unngår både ubrukelige sykluser og sløsing med energi for overdreven prosessering av underlag i overflod eller mangel på mangel.
Tilsvarende er denne reguleringsmekanismen av stor betydning for cellesignaleringsprosesser, der mange konformasjonsendringer som utløses av foreningen av forskjellige ligander på spesifikke steder for de aktuelle reseptorene er involvert.
Eksempler på alosterisme
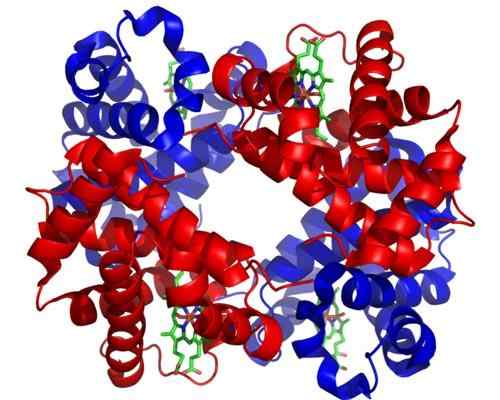 Hemoglobin. Tatt og redigert fra: Zephyris på engelskspråklig Wikipedia [CC By-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]].
Hemoglobin. Tatt og redigert fra: Zephyris på engelskspråklig Wikipedia [CC By-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Selv om det er tusenvis av eksempler på toosterismen eller reguleringen av naturen, har noen vært mer fremtredende enn andre. Slik er tilfellet med hemoglobin, som var et av de første proteiner som er beskrevet i dybden i det strukturelle aspektet.
Hemoglobin er et veldig viktig protein for mange dyr, ettersom det er ansvarlig for transport av oksygen gjennom blodet fra lungene til vevet. Dette proteinet presenterer homotropisk og heterotropisk til teosterisk regulering samtidig.
Kan tjene deg: Saltakionisme: Kjennetegn, bevis og eksemplerHomotropisk alosterisme av hemoglobin har å gjøre med foreningen av et oksygenmolekyl til en av underenhetene som komponerer det direkte påvirker affiniteten som underenheten ved siden av et annet oksygenmolekyl er bindende, og øker den (positiv eller kooperativisme regulering).
Heterotropisk til heterotropisk
Heterotropisk alosterisme er derimot relatert til effekten av både pH og tilstedeværelsen av 2,3-diffoglyserat på oksygenforeningen til underenhetene til dette enzymet, og hemmer det.
Transcarbamilase eller ATCASA Aspartate, som deltar i pyrimidinsyntese -ruten, er også et av de "klassiske" eksemplene på alosterisk regulering. Dette enzymet, som har 12 underenheter, hvorav 6 er katalytisk aktive og 6 er regulatorer, blir hemmet heterotropisk av sluttproduktet av ruten som hoder, cytidininatrifosfat (CTP).
Laktoseoperon OG. coli
Frukten av de første ideene til Monod, Jacob og Changeaux var en artikkel publisert av Jacob og Monod relatert til laktosen til laktosen til laktosen til laktosen Escherichia coliYo, som er en av de typiske heterotropiske til eksempler på genetisk nivå reguleringer.
Den toostale reguleringen av dette systemet er ikke relatert til evnen til å konvertere et underlag til et produkt, men til affiniteten til forening av et protein til det opererende DNA -regionen.
Referanser
- Changeux, J. P., & Edelstein, S. J. (2005). Allosteriske mekanismer for signaloverføring. Science, 308 (5727), 1424-1428.
- Goldbeter, a., & Dupont, g. (1990). Allosterisk regulering, kooperitet og biokjemiske svingninger. Biophysical Chemistry, 37 (1-3), 341-353.
- Jiao, w., & Parker, og. J. (2012). Bruke en bestemmelse av beregningsmessige og eksperimentelle teknikker for å forstå molekylært grunnlag for proteinallosteri. I fremskritt innen proteinkjemi og strukturell biologi (volum. 87, s. 391-413). Akademisk presse.
- Kern, d., & Zuiderweg, og. R. (2003). Dynamikkens rolle i allosterisk regulering. Nåværende mening i strukturell biologi, 13 (6), 748-757.
- Laskowski, r. TIL., Gerick, f., & Thornton, J. M. (2009). Det strukturelle grunnlaget for allosterisk regulering i proteiner. FEBS Letters, 583 (11), 1692-1698.
- Mathews, c. K., Van Holde, K. OG., & Ahern, K. G. (2000). Biokjemi, red. San Francisco, Calif.
- « Karbon nanorørstruktur, egenskaper, applikasjoner, toksisitet
- Adaptiv strålingsprosess, typer og eksempler »

