Natrium azida (NAN3) struktur, egenskaper, bruksområder, risikoer

- 4015
- 139
- Prof. Joakim Johansen
De Natriumazid Det er et krystallinsk uorganisk fast stoff dannet av natriumionen Na+ Og azida n ion3-. Den kjemiske formelen er nan3. Nan -forbindelsen3 Det er natriumsaltet av HN hydrazosyre3. Nan3 Det er et krystallinsk fast stoff av fargeløst til hvitt.
Selv om det er en veldig giftig forbindelse, har en av de mest utbredte jobbene vært i kollisjonsputene som øyeblikkelig er smittet under kjøretøyulykker. Det tjener også til å raskt blåse nødglidene på flyet. Imidlertid blir bruken av for øyeblikket veldig spørsmål i begge tilfeller for sin toksisitet.
 Natrium nan azid3 fast. И.С. Непонов [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Natrium nan azid3 fast. И.С. Непонов [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Det brukes i kjemiske forskningslaboratorier for å syntetisere forskjellige typer forbindelser og i biokjemiske laboratorier for studier med bakterier, sopp eller pattedyr eller menneskelige celler.
I noen laboratorier brukes det til å sterilisere materialer eller utstyr, men visse typer mikroorganismer motstår deres biocidale handling.
Det har også blitt brukt i landbruket for å eliminere jordparasitter eller i tømmerindustrien for å forhindre at furuved farging med sopp.
[TOC]
Struktur
Natrium azida nan3 Det dannes av et natriumna -kation+ og en azidanion n3-.
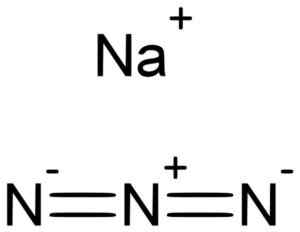 Natrium azida dannes av natrium na+ Og azida n ion3-. Lukáš Mižoch [Public Domain]. Kilde: Wikimedia Commons.
Natrium azida dannes av natrium na+ Og azida n ion3-. Lukáš Mižoch [Public Domain]. Kilde: Wikimedia Commons. Azida n ion3- Den består av 3 nitrogenatomer (n) forent av hverandre av kovalente bindinger som kan være enkle, doble eller trippel, ettersom elektroner deles mellom de tre.
Denne anionen har en lineær struktur, det vil si de tre nitrogenatomene anordnet i en rett linje. I tillegg er strukturen symmetrisk.
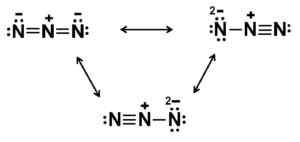 Mulige Lewis -strukturer av Azida Anion. Forfatter: Marilú Stea.
Mulige Lewis -strukturer av Azida Anion. Forfatter: Marilú Stea. Nomenklatur
- Natriumazid
- Natrium azida
Egenskaper
Fysisk tilstand
Krystallinsk fargeløs til hvit. Sekskantede krystaller.
Molekylær vekt
65,01 g/mol
Smeltepunkt
Den dekomponerer ved 275 ºC.
Tetthet
1.846 g/cm3 ved 20 ºC
Løselighet
Det er veldig løselig i vann: 41,7 g/100 ml ved 17 ºC. Det er litt løselig i etanol og uoppløselig i etyleter.
Dissosiasjonskonstanter
Den har en PKb 9.3. Vandige oppløsninger inneholder NH3, som raskt slipper unna miljøet på 37 ºC.
Kjemiske egenskaper
Nan3 Det er veldig etsende mot aluminium og moderat mot kobber og bly.
Kan tjene deg: nitrogen -valensI følge en viss konsulent kilde er natriumazid ikke eksplosiv. Den dekomponerer forsiktig og helt når den varmes opp ved 300 ºC eller mer, og danner natriummetall og nitrogengass N2.
2 Nan3 → 2 Na + 3 n2↑
Det er et nitrorasjonsmiddel, dette betyr at det tjener til nitrogen eller tilsett nitrogen til andre kjemiske forbindelser eller til overflaten av materialer som stål.
Det er stabilt i nøytralt eller alkalisk vann i fravær av lys. Den dekomponerer gjennom solstråling.
Biokjemiske egenskaper
Natriumazid hemmer et enzym kalt cytokromoksidase som finnes i mitokondriene til celler og er betydelig involvert i pusting og energiproduksjon i denne.
Handlingen forhindrer ATP -generasjon fra en nøkkelforbindelse i celleaktiviteter, og cellen forverres eller skader.
Hvis det blir inntatt, inhalert eller kontakt med natriumazidet, er det veldig giftig og kan bli dødelig.
Å skaffe
NH ammoniakk reagerer3 Med metallbrus ved 350 ºC i en lukket stålbeholder, og skaffet amid fra natrium nanh2.
Natrium nanh2 Det reagerer med dyitrogenmonoksid n2Eller ved 230 ° C i en nikkelreaktor, og dermed dannes en blanding av natrium NAN3, Natriumhydroksyd NaOH og ammoniakk NH3.
2 Nanh2 + N2O → Nan3 + NaOH + NH3
Det kan også oppnås ved å reagere natriumamid med nano -natriumnitrat3 ved 175 ºC:
3 Nanh2 + Eldre bror3 → Nan3 + 3 NaOH + NH3
For å rense azidet tilsettes vann til blandingen, krystallene til azidet vaskes, og deretter fordamper vannet. Det krystallinske materialet som gjenstår er azidet til natrium nan3 som deretter tørker ved 110 ºC.
applikasjoner
I motorvogner og fly
Natriumazid har blitt mye brukt i bilindustrien som nitrogengenerator for raskt å blåse opp luftposer (engelsk Kollisjonsputer) Sikkerhet for bilflyveblad og lastebiler når en innvirkning oppstår.
Det har også blitt brukt i oppblåsbare lysbilder som tjener til å rømme raskt fra det indre av flyene som har landet i nødsituasjoner.
I begge tilfeller involverer mekanismen virkningen av en gnist for å produsere den umiddelbare reaksjonen mellom natriumazid og visse forbindelser, og genererer nitrogengass N2 og natriumoksid Na2ENTEN.
Kan tjene deg: Dobbelt substitusjonsreaksjonDenne applikasjonen krever øyeblikkelig frigjøring av en kald og ikke-teknisk gass, så nitrogen er den mest passende gassen.
 Sikkerhetsposer som allerede har blitt brukt i kjøretøy. Forfatter: Marcel Langthim. Kilde: Pixabay.
Sikkerhetsposer som allerede har blitt brukt i kjøretøy. Forfatter: Marcel Langthim. Kilde: Pixabay. Imidlertid synker denne bruken på grunn av toksisiteten til natriumazid og brukes i stedet mindre giftige forbindelser.
I den kjemiske industrien
Det brukes som en retarder i gummiproduksjon for svamper, for å forhindre koagulering av strekk- eller butadien -latex når de lagres i kontakt med metaller og for å dekomponere nitritter i nærvær av nitrater.
I landbruket
Det har blitt brukt i landbruket: som biocidal og fumigant, er det også nematikid, det vil si at det brukes i jordsmonn for å eliminere nematoder, som er parasitter som angriper noen avlinger.
 Skader forårsaket av nematoder ved roten til en plante. Forfatter: Redwolf. [http: // www.Ars-Grin.Gov/ARS/Soatlantic/FP/STPP/Burelle/Burelle.HTML] Kilde: Wikimedia Commons.
Skader forårsaket av nematoder ved roten til en plante. Forfatter: Redwolf. [http: // www.Ars-Grin.Gov/ARS/Soatlantic/FP/STPP/Burelle/Burelle.HTML] Kilde: Wikimedia Commons. Det har også fungert som ugressmiddel og for å unngå råtne frukt.
Nylig Nan3 Det har blitt brukt i utarbeidelsen av okra eller kvimbombó frø for å observere dens motstand mot vannloggingsforhold.
Frøene som Nan tidligere ble brukt til3 De genererte frøplanter som bedre trukket tilbake flomforholdene enn de urimelige, forbedret høyden på plantene, økte antall blader og økte mengden røtter selv med overflødig vann.
Ved fremstilling av andre kjemiske forbindelser
Det brukes som et kjemisk reagens i syntesen av organiske forbindelser, for eksempel for å fremstille mange organiske azider, for eksempel de tertiære alkylgruppens azider, som er viktige i kjemisk syntese.
Det tjener til å fremstille hydrazosyre (HN3) og ren natrium (Na).
I eksplosiv industri
Natrium azida nan3 Det er en mellomledd i eksplosiv produksjon, ettersom den brukes til utarbeidelse av bly -azid3)2. Sistnevnte er en forbindelse som eksploderer når den blir slått sterkt, så den brukes i konstruksjonen av detonerende enheter.
 Natrium azida nan3 Den brukes til å produsere PB -ledningen (n3)2 forbindelse som er en del av enheter for å generere eksplosjoner. Forfatter: OpenClipart-vektorer. Kilde: Pixabay.
Natrium azida nan3 Den brukes til å produsere PB -ledningen (n3)2 forbindelse som er en del av enheter for å generere eksplosjoner. Forfatter: OpenClipart-vektorer. Kilde: Pixabay. I biokjemiske laboratorier
Natriumazid brukes når det kreves sterilt laboratorieutstyr, da det er i stand til å ødelegge forskjellige typer mikroorganismer.
Det kan tjene deg: Hypofysesyre (H3PO2): Egenskaper, bruksområder og reagenserDet er et biocidalt middel. Noen kilder indikerer imidlertid at noen typer bakterier er resistente mot deres virkning.
Dette oppnås ved å blokkere oksygenbindingsstedet i oksidase -cytokrom som er et enzym involvert i energiproduksjonsprosessen til noen mikroorganismer.
Det brukes i automatiske blodtellere, også i differensialvalget av bakterier og for å bevare laboratorireagensløsninger fordi det forhindrer veksten av visse mikroorganismer i disse.
I flere bruksområder
Natrium Azida serverer i treindustrien for å unngå vekst av brune soppflekker på furu tre.
Det har også blitt brukt i den japanske ølindustrien for å unngå utvikling av en sopp som mørkner den drinken.
Risiko
Natriumazid er en giftig forbindelse som hemmer et viktig enzym for pust og liv i mennesker og dyr. Det har blitt funnet at det alvorlig kan påvirke cellevevscellene i hjerneblodkaret.
Dens umiddelbare virkning etter inntak, innånding eller hudkontakt er å senke blodtrykket farlig, noe som kan føre til død. Derfor må det manipuleres med stor forsiktighet.
Det er informasjonskilder som vekker oppmerksomhet til kollisjonsputer av kjøretøyer som er ødelagt på avfallsplass.
I slike tilfeller kan personer som ikke kjenner faren få tilgang til NAN -forekomster3, Dette er en veldig giftig forbindelse. I tillegg er det fare for forurensning med NAN3 Jord og vann.
På samme måte, under ulykker, kan kollisjoner eller kjøretøybranner bli utsatt for NAN3 Og dette kan undervurderes eller ukjent av det medisinske personalet som deltar på nødsituasjonen.
Oppmerksomhet til utstillingen av laboratoriepersonell som bruker det, har også blitt kalt.
Referanser
- Vwioko, e.D. et al. (2019). Natriumazidgrunning forbedrer vannlogging av stresstoleranse i Okra (Abelmoschus esculentus). Agronomy 2019, 9, 670. MDPI kom seg.com.
- Kho, d.T. et al. (2017). Endotelceller i blodets hjernebarriere til natriumazid og gassprodukter. Biosensors 2017, 7, 41. MDPI kom seg.com.
- ELLER.S. National Library of Medicine. (2019). Natriumazid. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov.
- Talavera, m. et al. (2019). Nematodebehandling i jordbærfeltene i Sør -Spania. Agronomy 2019, 9, 252. MDPI kom seg.com.
- Okano, t. et al. (nitten nitti fem). Mekanisme for celleavløsning fra temperaturmodulerte, hydrofil-hydrofobe polymeroverflater. I Biomaterials: Silver Jubilee Compendium. Gjenopprettet fra Scientedirect.com.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte utgave. Volum A22. VCH Verlagsgellschaft MBH.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Chang, s. og Lamm, s.H. (2003). Menneskelige helseeffekter av eksponering for natriumazid: en litteraturgjennomgang og analyse. Int J Toxicol 2003, 22 (3): 175-86. NCBI kom seg.NLM.NIH.Gov.

