Bromotimolblått

- 1764
- 359
- Jonathan Carlsen
 Bromotimol Blue er en pH -indikator. Kilde: Wikimedia Commons
Bromotimol Blue er en pH -indikator. Kilde: Wikimedia Commons Hva er bromotimolblått?
Han Bromotimolblått Det er et derivat av trifenylmetano som fungerer som en pH -indikator. En indikator er et organisk fargestoff hvis farge avhenger av konsentrasjonen av ionen H3ENTEN+ eller av medium pH. På grunn av fargen den viser, kan indikatoren indikere surheten eller alkaliniteten til løsningen.
Bromotimol Blue har en aktiv indikasjonsskala mellom en pH 6.0 og 7.6. Til en pH av mediet mindre enn 6.5 (syre) manifesterer en gul farge. Når medium pH varierer mellom 6.5 og 7.6 (nøytral), skaffer seg en grønn farge. En pH større enn 7.6 fargen er blå (grunnleggende).
Denne funksjonen gir den et flott verktøy, siden den kan brukes på en pH -skala nær nøytralitet, nettopp der fysiologiske prosesser oppstår.
Bromotimolblå ionisering i vandig løsning kan skjematiseres som følger:
Hin (gul) +h₂o i- (blå farge) + h3ENTEN+
Når indikatoren er protonert (HIN) tilegner seg en gul farge; Mens indikatoren er ubeskyttet (i-) Fargelegging er blå.
Kjemisk struktur
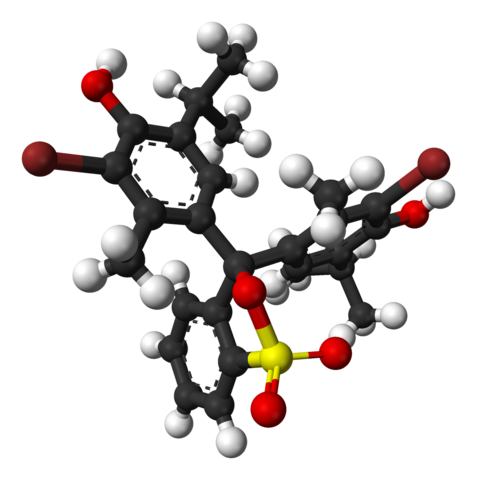 Kjemisk struktur av bromotimolblått. Kilde: Wikimedia Commons
Kjemisk struktur av bromotimolblått. Kilde: Wikimedia Commons I det øvre bildet er strukturen til Bromotimol Blue representert med en barmodell og sfærer til en pH mindre enn 7.1. Brune søyler tilsvarer bromatomer, to totalt.
Hver av de tre aromatiske ringene komponerer, ved siden av metylgruppene, CH3, Og termisk, Timol Group, og etter å ha koblet en BR, derfra kalles grunnen 'Bromotimol'.
Kan tjene deg: hydroksiderI den nedre delen vises sulfonatgruppen, R-SO3-, Med røde kuler og en gul. Denne gruppen kan kobles gjennom et atom eller et sentralt karbon som blir sammen med de tre aromatiske ringene.
PH endrer
Denne molekylære strukturen, selv om den ikke endres radikalt med sur eller basisk pH, endrer dens elektroniske tilstander, reflektert av fargeendringer av løsninger.
Under pH 7 er indikatoren gul og vedtar strukturen til bildet, men hvis pH blir grunnleggende, er gruppene -OH uheldige og en dobbeltbinding kan dannes C = O.
Som et resultat endres det konjugerte systemet til molekylet (det for alle dets doble resonansbindinger) nok slik at elektroner ikke lenger absorberer de samme fotonene, og løsningen blir fra gul til blåaktig.
Hvis pH -en derimot er godt under 7, endres fargen på indikatoren fra gul til rød. Her skyldes endringen i det konjugerte systemet protonasjonen av gruppene -OH a -OH2+. -
I både surt og basisk medium mister molekylet stabiliteten, og absorberer mindre fotoner for å tillate elektroniske overganger som.
Den grønne fargen observert i hovedbildet skyldes følgende: når pH ved 7 tilnærmer seg.1, en liten del av molekyler mister protoner og sier farvel til en blå farge som, blanding med gult, gir den grønne fargen.
Egenskaper dBromootimol Blue
Kjemisk navn
Bromotimol Blue eller 3,3'-dibromotimolsulfonafet.
Molekylær formel
C27H28Br2ENTEN5S.
Molekylær vekt
624.384 g/mol.
Fysisk utseende
Solidfarge støv som varierer mellom rosa og lilla.
Kan tjene deg: Butanal: Struktur, egenskaper, bruksområderKjemisk karakteristikk
Fungerer som en svak syre i løsning. Når det er protonert i et surt medium, får det en gul farge, en nøytral pH er grønn, og når den er ubehagelig i en alkalisk pH er den blå.
Ionisk dissosiasjonskonstant (Ka)
7.9 x 10-8.
Aktiv indikasjonsområde
pH 6.0 til 7.6. Dette skyldes tilstedeværelsen av bromatomer som virker ved å trekke ut elektroner, og to moderate elektrondonorgrupper (alkylsubstituenter).
Tetthet
1.25 g/cm3.
Smeltepunkt
202 ° C (396 ° F).
Kokepunkt
184.9 ° C.
Løselighet
Det er knapt løselig i vann og olje. Det er også lite oppløselig i ikke -polare løsningsmidler som benzen, toluen og xylen, og praktisk talt uoppløselig i oljeeter. Det er løselig i vandige oppløsninger av alkalier og alkohol.
Stabilitet
Det er stabilt ved omgivelsestemperatur og uforenlig med sterke oksidasjonsmidler.
Lysabsorpsjon
Den protonerte formen har sin maksimale absorpsjon i en bølgelengde (λ) på 427 nm, og overfører dermed gult lys i syreoppløsninger, og den ubeskyttede formen har en maksimal absorpsjon ved en bølgelengde (λ) på 602 nm, og overfører en lys en lys blå til alkalisk pH.
Bruk og applikasjoner
I metabolske studier
Bromotimolblått brukes i en rekke prosesser der karbondioksid (CO₂) produseres, med den påfølgende generasjonen av karboninsyre (H2Co3), som surerer mediet, noe som fremgår av en endring i fargelegging av bromotimolblått.
Hvis en person utfører en fysisk øvelse og er koblet til et rør som på sin side er i forbindelse med en beholder med en løsning av bromotimolblått, vil følgende fenomen bli observert: som en konsekvens av økningen i fysisk aktivitet og Metabolisme, en økning i CO₂ -produksjonen vil skje.
Kan tjene deg: silisium: historie, egenskaper, struktur, innhenting, brukCO₂ vil reagere med vann, og produserer kullsyre, h2Co3, som senere dissosierer og slipper ion h+ og forsurende mediet. Dette resulterer i Bromotimol Blue tilegner seg en gul farge, og fremhever miljøets surhet.
I fødselshjelp
Bromotimol Blue brukes i fødselshjelp for å vise en tidlig brudd på membraner. Fostervannet har normalt en pH større enn 7.7, så Bromotimol Blue vil fargelegge blått, når den kommer i kontakt med væsken som slipper unna amnio.
Vaginal pH er vanligvis sur, så bromotimolblå har en gul farge. Endringen av fargen til blå manifesterer tilstedeværelsen av fostervann i vaginalområdet.
Andre bruksområder
Bromotimol Blue har også påføring i følgende utstyr og funksjoner:
- Optiske sensorer
- Gassforbrenningsdeteksjonssystemer
- I utdyping av malerier, leker, rengjøringsprodukter, vaskemidler og tekstiler
- Matfriskhetssensorer
- Som fersk risidentifikator og harsk
- I påvisning av mikroorganismer.
Det brukes også i bakteriell vekstanalyse, psykoaktive medisiner og tannmaterialer.
Forberedelse
100 mg bromotimolblått blir oppløst i 100 ml fortynnet alkohol, og filtre om nødvendig. Det tilberedes også som følger: 50 mg bromotimolblått blir oppløst i en blanding av 4 ml 0,02 N natriumhydroksyd og 20 ml alkohol, og fullfører 100 ml med vann med vann.
Referanser
- Foist l. Bromothymol Blue: Definisjon, bruk og formel. Studie ble frisk.com
- Bromothymol blå pH -indikator, 1 oz. Gjenopprettet fra Sciencecompany.com
- Spektrofotometrisk bestemmelse av PK av bromotymolblå indikator. Gjenopprettet fra FCH.Upol.CZ

