Balansering av kjemiske ligninger
- 2119
- 401
- Marius Aasen
Hva er balansering av kjemiske ligninger?
Balansering av kjemiske ligninger er en matematisk operasjon som utføres for å opprettholde loven om bevaring av materie i reaksjoner. Materie er ikke opprettet eller ødelagt. Derfor må antallet atomer før og etter en kjemisk reaksjon være det samme, både i reagensene og i produktene.
For å balansere en kjemisk ligning må du telle atomene før og etter pilen. Hvis tallene sammenfaller, betyr det at reaksjonen er balansert. Ellers vil det være nødvendig å matche disse tallene ved å endre de støkiometriske koeffisientene etter prøving og feiling, dette er den enkleste og mest intuitive metoden for balanse.
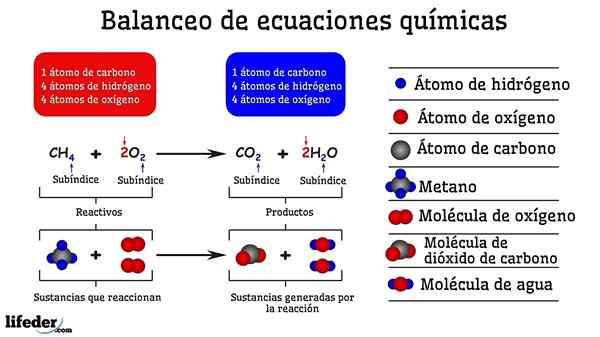
 Eksempel på kjemisk balansering av reaksjonen mellom metan og to oksygenmolekyler
Eksempel på kjemisk balansering av reaksjonen mellom metan og to oksygenmolekyler Når det er balansert av prøving og feiling, er det som om de ble fjernet eller tilsatt atomer på en av de to sidene av Subbaja. Inntil subbajaen ikke er suspendert horisontalt, vil den kjemiske ligningen ikke være fullstendig balansert. Det kan ikke være mer (skape materie) eller mindre atomer (ødelegge materie) på noen sider.
Enkle balansering av eksempler på ligninger
I de følgende eksemplene vil du se balanserte eller enkle å balansere kjemiske ligninger. Alle må ha til felles at antallet atomer, for hvert av elementene, vil være det samme før og etter pilen når den kjemiske ligningen er balansert.
Kvikksølvoksidasjon
2hg +o2 → Hg2ENTEN2
Vi har to elementer: kvikksølv (HG) og oksygen (O). Vi uttrykker antall atomer før (reagenser) og deretter (produkter) av pilen:
HG: 2 (til venstre) - 2 (til høyre)
Det kan tjene deg: molar fraksjon: hvordan det beregnes, eksempler, øvelserO: 2 (til venstre) - 2 (til høyre)
Ligningen er balansert fordi Hg -atomer og eller er den samme på begge sider av pilen.
Hydrogenforbrenning
H2 + ENTEN2 → H2ENTEN
Vi har to elementer igjen: hydrogen (H) og oksygen (O). Gjenta forrige trinn:
H: 2 - 2
O: 2 - 1
På venstre side er det et oksygen mer enn til høyre. Vi må derfor legge til en annen riktig oksygen. For å gjøre dette, endrer vi de støkiometriske koeffisientene, som er tallene som følger med og går foran formlene. Hvis vi plasserer en 2 foran H2Eller vil gi oss:
H2 + ENTEN2 → 2H2ENTEN
H: 2 - 4
O: 2 - 2
Oksygen er balansert. Men ikke hydrogener. Du må legge til to hydrogener nå til venstre:
2H2 + ENTEN2 → 2H2ENTEN
H: 4 - 4
O: 2 - 2
Og ligningen er endelig balansert: samme antall H og eller før og etter pilen.
Merk at støkiometriske koeffisienter (2 for h2 og 1 for o2) Multipliser abonnentene til formlene. Denne multiplikasjonen vil gi oss det totale antallet atomer for et spesifikt element.
Magnesiumreduksjon
MG (nei3)2 + 2li → Mg +2lino3
Vi evaluerer atomnumre for hvert element:
MG: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
Den kjemiske ligningen er allerede balansert, og det er ikke nødvendig å balansere den.
Løste øvelser
Før du fortsetter med å balansere enhver ligning, er det alltid nødvendig å bekrefte om den ikke lenger er balansert. Når det er sagt, fortsetter vi med følgende øvelse:
Oppgave 1
Balansert eller ikke?
Tro2ENTEN3 + H2O → tro (OH)3
Vi har tre elementer: jern (tro), hydrogen og oksygen. Et forslag på tidspunktet for balanse ligninger er å begynne å telle atomnumrene til det mindre rikelig elementet i ligningen; som vanligvis er forskjellig fra H og O. Dermed teller vi først troens atomer:
Det kan tjene deg: metylsalisylatTro: 2 - 1
Abonnement 3 av (OH)3 Ikke multipliser troen til venstre. For H og O har vi:
H: 2 - 3
O: 4 - 3
Alle elementene er ubalanserte.
Svingende
Før til og med balanserer H og O, må vi balansere troens atomer: det minst rike elementet, siden det knapt er 3 tro, i motsetning til 5 timer og 7 eller 7 eller 7. Du må legge til en tro til høyre:
Tro: 2 - 2
Det som er lik en 2 som støkiometrisk koeffisient foran troen (OH)3. Ligningen vil forbli:
Tro2ENTEN3 + H2O → 2fe (OH)3
Tro: 2 - 2
H: 2 - 6
O: 4 - 6
Men H og O eller fortsetter ubalansert. En h2Eller bidra med 2 timer og vi mangler 4 timer. Derfor vil vi legge til ytterligere to H2Eller for oss å ha tre H2ENTEN:
Tro2ENTEN3 + 3H2O → 2fe (OH)3
Og vi evaluerer igjen:
Tro: 2 - 2
H: 6 - 6
O: 6 - 6
Legg merke til hvordan de balanserte dem når vi en gang balanserte h. Ligningen er endelig balansert.
Oppgave 2
Balansert eller ikke?
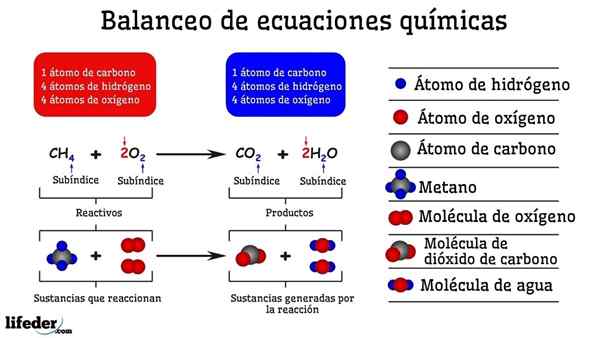
Ch4 + ENTEN2 → co2 + H2ENTEN
Vi evaluerer antall atomer for alle de nåværende elementene:
C: 1 - 1
H: 4 - 2
O: 2 - 3
Karbon er balansert, men det samme skjer ikke med hydrogen og oksygen. Ligningen er ubalansert.
Svingende
Siden C er balansert, ønsker vi ikke å endre de støkiometriske koeffisientene til CH4 eller co2. I det minste ikke i prinsippet.
Vi fokuserer oppmerksomheten på H og O, spesielt på H. Fordi? For å se ligningen er det lettere å balansere H før eller. Vi må legge 2 timer til høyre, plassere en koeffisient 2 foran H2ENTEN:
Ch4 + ENTEN2 → co2 + 2H2ENTEN
C: 1 - 1
H: 4 - 4
O: 2 - 4
C og H er balansert. Vi er igjen 2 eller igjen. Hvis hver eller2 bidrar med 2 eller vil vi legge til en eller2 ekstra slik at de er 4 eller til venstre. Dette er det samme som å plassere en koeffisient 2 foran O2:
Kan tjene deg: svoveloksidCh4 + 22 → co2 + 2H2ENTEN
C: 1 - 1
H: 4 - 4
O: 4 - 4
Og ligningen er endelig balansert.
Øvelse 3
Balansert eller ikke?
N2 + H2 → NH3
Vi evaluerer for våre to elementer n og h:
N: 2 - 1
H: 2 - 3
Ligningen er ikke balansert.
Svingende
Vi begynner å balansere n, elementet forskjellig fra H. Vi mangler en rettighet, og som hver NH3 bidrar med 1 n, vi må legge til en annen NH3 Å ha 2 n:
N2 + H2 → 2NH3
N: 2 - 2
H: 2 - 6
Og nå savner vi venstre. Hvis hver h2 Bidra med 2 timer til ligningen, så må vi legge til ytterligere to slik at det er 6 timer. Dette er det samme som å plassere en støkiometrisk koeffisient 3 foran H2:
N2 + 3H2 → 2NH3
N: 2 - 2
H: 6 - 6
Og den kjemiske ligningen er endelig balansert.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Kjemi librettexts. (23. november 2020). Hvordan skrive balanserte kjemiske ligninger. Gjenopprettet fra: Chem.Librettexts.org
- Wikipedia. (2020). Kjemisk ligning. Hentet fra: i.Wikipedia.org
- Prinsipper for kjemi. (s.F.). Skrive og balansere kjemiske ligninger. [PDF]. Hentet fra: Web.Ung.Edu
- PHET. (s.F.). Balansering av kjemiske ligninger. Gjenopprettet fra: PHET.Colorado.Edu
- Armando Marín f. (s.F.). Generell kjemi: balansering av ligninger. [PDF]. Gjenopprettet fra: Depa.Fquim.Unam.MX

