Benzaldehyd
- 1533
- 246
- Jonathan Carlsen
Vi forklarer hva benzaldehyd, dens fysiske og kjemiske egenskaper, kjemisk struktur, anvendelser og syntese er
 Kjemisk struktur av benzaldehyd
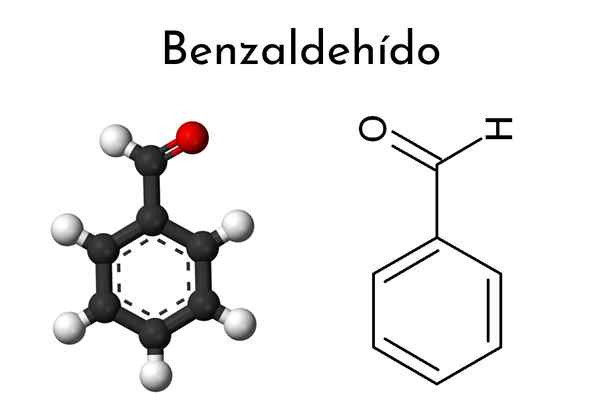
Kjemisk struktur av benzaldehyd Hva er benzaldehyd?
Han Benzaldehyd Det er en organisk forbindelse hvis kjemiske formel er c6H5Cho. Ved romtemperatur er det en fargeløs væske som kan bli gulaktig med lagring. Representerer den enkleste aromatiske aldehyd og den mest brukte industrielt. I denne er formilgruppen koblet direkte til benzenringen.
Det finnes naturlig i cortex av stilkene, blader og frø av planter, for eksempel: mandel, kirsebær, fersken og eple. Det kan også finnes i olje mandeloljer, Patchulí, Jacinto og Cananga. Benzaldehyd kan tas opp av huden og lungene, men blir raskt metabolisert til benzosyre.
Dette er kombinert med glukuronsyre eller glycin, og skilles ut i urinen. Det brukes som en smakstilsetning av noen matvarer, i parfymeindustrien og i legemiddelindustrien. Den største viktigheten er at fra benzaldehyd, forbindelser som benzylsyre, kynaminsyre, mandelisk syre, etc.
De tidligere utnevnte forbindelsene har mange bruksområder. Benzaldehyd er også et inkompatibelt drivstoff med sterke oksidasjonsmidler, sterke syrer og reduserende midler og lys.
Benzaldehyd fysiske og kjemiske egenskaper
Kjemiske navn
Benzaldehyd, benzoisk, benzenokarbonal, fenylmetanal og benzenokarboksaldehyd aldehyd.
Molekylær formel
C7H6O o c6H5Cho
Farge
Det er en fargeløs væske som kan bli gulaktig.
Lukt
Ligner på bitter mandel.
Smak
Brennende aromatisk.
Kokepunkt
- 354 ºF ved 760 mmhg.
- 178,7 ºC.
Fusjonspunkt
- 15 ºF.
- 26 ºC.
Løselighet
- I vann, 6.950 mg/l ved 25 ° C, fordi det er en overveiende apolar forbindelse og interagerer svakt med vannmolekyler.
- Blandelig med alkohol, eter, faste og flyktige oljer.
- Løselig i flytende ammonium, apolar løsningsmiddel.
Tetthet
- 1.046 g/cm3 ved 68 ºF.
- 1.050 g/cm3 ved 15 ºC.
- Dampen er tettere enn luft: 3,65 ganger i forhold til dette.
Stabilitet
Det er stabilt ved romtemperatur. Imidlertid oksidert i luften til benzosyre.
Goo
1.321 cp ved 25 ° C
Struktur
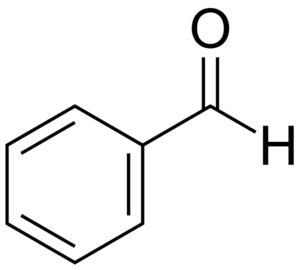
Som det kan sees i det første bildet, er strukturen til benzaldehyd. Så, benzaldehyd er en organisk, aromatisk og polar forbindelse.
Hva er dens molekylære geometri? Fordi alle karbonatomer som utgjør benzenringen har SP2 -hybridisering, så vel som for formylgruppen, hviler molekylet på samme plan, og følgelig kan det visualiseres som et kvadrat (eller rektangel, sett aksialt).
Intermolekylære interaksjoner
Formilgruppen etablerer et permanent dipolmoment i benzaldehydmolekylet, selv om det er bemerkelsesverdig svakt sammenlignet med benzosyre.
Dette lar deg ha sterkere intermolekylære interaksjoner enn benzenen, hvis molekyler bare kan samhandle gjennom London-styrker (induserte dipol-dipol-dipmers).
Ovennevnte gjenspeiles i dets fysiske egenskaper, for eksempel kokepunktet, som er to ganger overlegen enn benzen (80 ºC).
I tillegg mangler formilgruppen evnen til å danne hydrogenbroer (hydrogen er knyttet til karbon, ikke med oksygen). Dette gjør det umulig for benzaldehydmolekyler å danne tre -dimensjonale arrangementer, slik som de som er observert i benzosyrekrystaller.
Bruk/applikasjoner
Additive og aromatiserende og smaksstoffer
Det er en forbindelse som fungerer som base for medisiner, fargestoffer, parfymer og i harpiksen. Det kan også brukes som et løsningsmiddel, mykner og smøremiddel for lave temperaturer. Det brukes til å aromatisere eller krydre mat og tobakk.
Det kan tjene deg: kaliumdikromat: formel, egenskaper, risikoer og bruksområderDet brukes til tilberedning av smaker, for eksempel mandel, kirsebær og nøtt. Det brukes også som et aromatiseringsmiddel i hermetisert kirsebærsirup. Det griper inn i utdypingen av områder av fiolett, jasmin, Acacia, solsikke, etc., og brukes i såpeproduksjon. Det brukes som drivstoff- og drivstofftilsetningsstoff.
Ukonvensjonelle applikasjoner
Det griper inn som et reagens i bestemmelsen av ozon, fenol, alkaloider og metylen. Det fungerer som en formidler av reguleringen av plantevekst.
Benzaldehyd og N-heptaldehyd hemmer snøsikrystallisering, og unngår dannelse av dype isforekomster, forårsaker snø almisser. Imidlertid er denne bruken innvendt fordi den er en kilde til miljøforurensning.
Frastøtende
Benzaldehyd brukes som en avvisende bier, ved å bruke i elveblest i forbindelse med røyken for å bevege seg bort bikuben og for å kunne jobbe uten risiko i disse, unngå bitt.
I syntesen av malakitten
Malakittgrønn er en sammensatt syntetisert med intervensjonen fra benzaldehyd. Fargestoffet brukes i fiskeoppdrett for å bekjempe fiskesykdommer, for eksempel bekjent av hvite punkter og soppinfeksjoner.
Det kan bare brukes i akvarier, siden skadelige effekter på pattedyr er rapportert, blant annet karsinogenese, mutagenese, teratogenese og kromosomal fakturering; Dette er grunnen til at bruken er forbudt i mange land.
Det brukes også i mikrobiologi for farging av bakteriesporer.
Syntetisk mellomledd
- Benzaldehyd er mellomledd i syntesen av kinaminsyren som brukes i krydder, men dens viktigste bruk er å oppnå metyl-, etyl- og benzylestere som brukes i parfymerindustrien. Kinaminsyre induserer cytastase og reversering av ondartede egenskaper til humane humane tumorceller In vitro.
- Benzaldehyd griper inn i syntesen av benzylalkohol, som selv om det brukes som matkryddering og industriell løsningsmiddel, er hovedfunksjonen å tjene som en mellomledd for syntese av forbindelser som brukes i farmasøytisk industri og produksjon av parfymer, krydder og litt anilin Fargestoffer.
- Benzaldehyd er en mellomledd i syntesen av mandelinsyre. Dette brukes til behandling av hudproblemer, for eksempel aldring på grunn av eksponering for sollys, uregelmessig pigmentering og kviser.
- Det har antibakteriell bruk som fungerer som et oralt antibiotika i urinveisinfeksjoner.
Syntese
Den mest brukte formen for benzaldehydsyntese er ved toluens katalytiske oksidasjon, ved bruk av manganoksydkatalysatorer (MNO2) og koboltoksyd (COO). Begge reaksjonene utføres med svovelsyre som et middel.

