Kaliumbenzoatstruktur, egenskaper, innhenting, bruk
- 2522
- 18
- Anders Mathisen
Han Kaliumbenzoate Det er en organisk forbindelse dannet av et ionekalium k+ og en benzoato c ion6H5COO-. Dens kjemiske formel er C6H5Kok eller kondensert formel C7H5Ko2. Det er et krystallinsk hvitt fast stoff. Det er hygroskopisk, noe som betyr at den absorberer luft fra luften.
Kaliumbenzoat vandige oppløsninger er litt alkalisk. I surt medium benzoation (c6H5COO-) har en tendens til å ta et proton og bli en benzosyre (C6H5COOH).
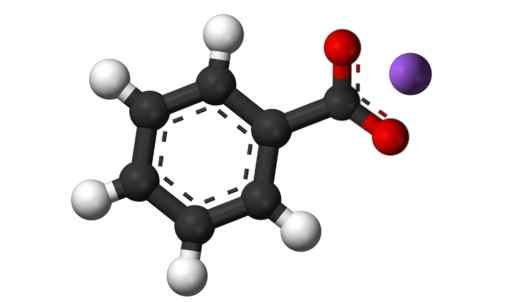
 Kaliumbenzoate6H5Solid kokk. W. Oelen [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Kaliumbenzoate6H5Solid kokk. W. Oelen [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Kaliumbenzoat brukes som matbeskyttelsesmiddel, spesielt når de er ønsket å være natriumfri (NA). Forhindrer at mat forverres på grunn av mikroorganismer.
Det brukes i pølser, bearbeidede brus og bakeriprodukter, blant annet mat. Sannsynligvis skyldes dens konserveringsmessige handlinger benzosyre (C6H5COOH) som dannes ved lav pH, som forhindrer reproduksjon av sopp og bakterier.
Selv om kaliumbenzoate er godkjent av helseorganisasjoner, er det praktisk å ikke misbruke bruken av dem, siden det har blitt funnet at fostrene til mus kan påvirke.
[TOC]
Struktur
Kaliumbenzoat er et organisk salt, det vil si et salt av en karboksylsyre, siden det er kaliumsaltet av benzosyre. Det dannes av en K+ kaliumkation og et benzoatanion C6H5COO-.
Benzoato C -anionen6H5COO- Det dannes av en benzenisk ring C6H5- og en karboksylat -coo -gruppe-.
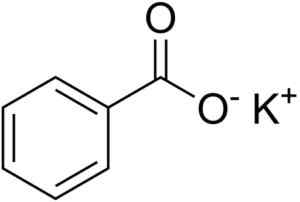 Kjemisk struktur av kaliumbenzoat. Edgar181 [offentlig domene]. Kilde: Wikimedia Commons.
Kjemisk struktur av kaliumbenzoat. Edgar181 [offentlig domene]. Kilde: Wikimedia Commons. Forbundet mellom disse to ionene er en sterk elektrostatisk forening som holder dem i det krystallinske nettverket.
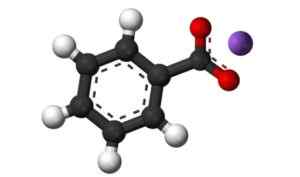 3D -struktur av kaliumbenzoat. Svart = karbon; Hvitt = hydrogen; rød = oksygen; Fiolett = kalium. Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
3D -struktur av kaliumbenzoat. Svart = karbon; Hvitt = hydrogen; rød = oksygen; Fiolett = kalium. Claudio Pistilli [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Nomenklatur
- Kaliumbenzoate
- Potasisk benzosyresalt
Egenskaper
Fysisk tilstand
Krystallinsk hvitt fast stoff.
Molekylær vekt
160,212 g/mol
Løselighet
Løselig i vann.
Ph
Kaliumbenzoat vandige oppløsninger er litt grunnleggende.
Kjemiske egenskaper
Det er hygroskopisk, det vil si at det er et fast stoff som absorberer vann fra miljøet enkelt.
Unionen mellom kaliumkionen+ og benzoato c ion6H5COO- Som i de fleste ioniske forbindelser kan det bare beseires ved høy temperatur eller av et veldig polært løsningsmiddel som vann.
Kan tjene deg: effektiv kjernefysisk belastningBenzoato C -anionen6H5COO- Det er moderat grunnleggende, med en betydelig tendens til å kombinere med protoner. Reagere med vann som tar en proton h+ Å danne benzosyre (c6H5COOH) og dette fører til en økning i OH -ionekonsentrasjonen-.
C6H5COO- + H2Eller ⇔ c6H5COOH + OH-
Av denne grunn er vandige kaliumbenzoatløsninger litt alkalisk.
Å skaffe
For å tilberede kaliumbenzoat, nøytraliseres benzosyre (C6H5Cooh) med kaliumkarbonat (k2Co3) I et minimumsvolum vann for å oppnå en klar løsning som salt krystalliserer.
2 c6H5COOH + K2Co3 → 2 c6H5COO-K+ + H2Eller + co2↑
Deretter vaskes det krystalliserte kaliumbenzoatsaltet flere ganger med eter og tørker.
applikasjoner
I den bearbeidede matindustrien
Kaliumbenzoate er mye brukt som et antimikrobielt middel for bevaring av drikkevarer, fruktderivater, bakeriprodukter og andre måltider.
 Noen bakeriprodukter kan inneholde kaliumbenzoate. Forfatter: Andrew Martin. Kilde: Pixabay.
Noen bakeriprodukter kan inneholde kaliumbenzoate. Forfatter: Andrew Martin. Kilde: Pixabay. Det er et matkonserveringsmiddel, i stand til å hemme, forsinke eller stoppe prosessen med gjæring, forsuring eller forringelse av mat på grunn av noen sopp og bakterier.
I følge miljøvern eller EPA -byrå (forkortelse for engelsk Miljøvernbyrå) Kaliumbenzoate er blitt bekreftet som en forbindelse med liten bekymring for menneskers helse.
Mot sopp
Det er et antimikotisk middel, fordi det kan ødelegge dem ved å undertrykke deres evne til å vokse eller reprodusere. Det er ikke et soppmiddel for vev av organisme av dyr eller mennesker, men en hemmer som forsinker eller bremser fremskritt av sopp i mat eller drikke.
Noen typer mugg produserer stoffer som kalles aflatoksiner, som er en trussel for både mennesker og dyr fordi de er giftige, de kan produsere kreft og mutasjoner.
De fleste former er hemmet i konsentrasjoner på 0,05-0,10% av kaliumbenzoat. Ytelsen til dette avhenger av pH, ettersom mindre pH er mer effektiv som antihongos.
Kan tjene deg: kalsiumhydroksyd (Ca (OH) 2): struktur, egenskaper, innhenting, bruk Behandlede brus kan inneholde kaliumbenzoate. Forfatter: Lisakara. Kilde: Pixabay.
Behandlede brus kan inneholde kaliumbenzoate. Forfatter: Lisakara. Kilde: Pixabay. Dette er fordi den antimikotiske handlingen i virkeligheten ligger i benzosyren C6H5COOH, som er den konjugerte syren til kaliumbenzoat. Denne syren dannes under pH, det vil si i nærvær av et stort antall hydrogenioner H+:
Kaliumbenzoate + hydrogenioner → Benzosyre + kaliumioner
C6H5Kok + H+ → c6H5COOH + K+
I følge noen forskere skyldes effektiviteten delvis løseligheten av benzosyre i mikroorganismecellemembranen. Denne typen syre øker strømmen av protoner gjennom nevnte membran.
Dette forårsaker avbrudd eller uorganisering av visse funksjoner i soppcellen.
Mot bakterier
Det er et middel som fungerer mot noen bakterier. Det legges til mat som bearbeidede pølser, bearbeidede skinker (klare til å spise) og litt drinker.
Har blitt testet mot Listeria monocytogenes, en bakterie som kan forårsake menneskers død som bruker mat forurenset med dette. Produserer feber, oppkast og diaré, blant andre symptomer.
Det har blitt funnet at mat behandlet med kaliumbenzoat og som har blitt forurenset med Listeria De må opprettholdes ved temperaturer under -2,2 ° C slik at slike bakterier ikke blir gjengitt.
 Pølser og annet pølsekjøtt kan inneholde kaliumbenzoat. Forfatter: Selging av bildene mine med Stockencies er ikke tillatt. Kilde: Pixabay.
Pølser og annet pølsekjøtt kan inneholde kaliumbenzoat. Forfatter: Selging av bildene mine med Stockencies er ikke tillatt. Kilde: Pixabay. På den annen side er bruken av elektronstråling blitt testet for å intensivere effekten av kaliumbenzoat mot bakterier, men det er bestemt at benzen C har produsert6H6 som er en giftig forbindelse.
Derfor, selv om mat inneholder kaliumbenzoat.
I flere applikasjoner
I følge kilder som er konsultert, brukes også kaliumbenzoate i lim og bindemidler for en rekke bruksområder. Det legges til sigaretter og tobakk eller er relatert til fremstilling av disse.
Kan tjene deg: neon: historie, egenskaper, struktur, risiko, brukDet brukes i personlig pleieprodukter som kosmetikk, sjampo, parfymer, såper, kremer, etc. Det er også en del av malerier og belegg.
Negative effekter på inntak av mat med kaliumbenzoate
Enkelte forskere fant at kaliumbenzoat gir skadelige effekter på musfostre.
Selv om det ikke var noen effekter på voksne mus utsatt for kaliumbenzoat.
 I følge laboratorieopplevelser kan musfostre påvirkes av kaliumbenzoat inntatt av moren. Forfatter: Tibor Janosi Mozes. Kilde: Pixabay.
I følge laboratorieopplevelser kan musfostre påvirkes av kaliumbenzoat inntatt av moren. Forfatter: Tibor Janosi Mozes. Kilde: Pixabay. Dette betyr at fostre er mer følsomme for kaliumbenzoat enn voksne mus.
Referanser
- Mandal, s.K. et al. (1978). Viskositetsatferd av benzosyre og benzoation i en vandig løsning. Journal of Solution Chemistry, Vol. 7, nei. 1, 1978. Lenke gjenopprettet.Springer.com.
- Rusul, g. og Marth, og.H. (1987). Vekst og aflatoksinproduksjon av Aspergillus parasiticus NRRL 2999 i forløpet av kaliumbnezat eller kaliumsorbat og ved innledende pH -verdier. J Food Pr. 1987; 50 (10): 820-825. NCBI kom seg.NLM.NIH.Gov.
- Lys. et al. (2005). Inhibitoriske effekter av organiske syresalter for kontroll av Listeria monocytogenes På Frankfurters. J Food Pr. 2005; 68 (3): 499-506. NCBI kom seg.NLM.NIH.Gov.
- Zhu, m.J. et al. (2005). Effekten av antimikrobielle ingredienser og bestråling på overlevelse av Listeria monocytogenes og kvaliteten på kalkunskinken med klart. Poult Sci. 2005; 84 (4): 613-20. NCBI kom seg.NLM.NIH.Gov.
- ELLER.S. National Library of Medicine. (2019). Kaliumbenzoate. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Afshar, m. et al. (2013). Teratogene effekter av Lont Term -forbruk av kaliumbenzoat på øyeutvikling i BALB/C fostermus. Iran J Basic Med Sci. 2013; 16 (4): 584-589. NCBI kom seg.NLM.NIH.Gov.
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Morrison, r.T. og Boyd, r.N. (2002). Organisk kjemi. 6. utgave. Prentice-Hall.
- « Institusjonelle verdier av administrasjonen hva de er for, betydning
- Magnetiske støtenheter, formler, beregning, eksempler »

