Kalsiumbikarbonat

- 2042
- 557
- Mathias Aas
 Kalsiumbikarbonat er et uorganisk salt av bikarbonatgruppen
Kalsiumbikarbonat er et uorganisk salt av bikarbonatgruppen Hva er kalsiumbikarbonat?
Han Kalsiumbikarbonat Det er et uorganisk salt med Ca kjemisk formel (HCO3)2. Det har sin opprinnelse i naturen fra kalsiumkarbonat som er til stede i kalkstein og mineralsteiner som kalsitt.
Kalsiumbikarbonat er mer oppløselig i vann enn kalsiumkarbonat. Denne funksjonen har tillatt dannelse av karst -systemer i kalkstein og i strukturering av hulene.
Grunnvannet som krysser sprekkene metter i karbondioksidforskyvningen (CO2).
Disse vannene eroderer kalksteinbergarter som frigjør kalsiumkarbonat (Caco3) at kalsiumbikarbonat vil danne, i henhold til følgende reaksjon:
Tyv3(S) +CO2(g) +h2Eller (l) => ca (HCO3)2(En q)
Denne reaksjonen forekommer i hulene der veldig hardt vann stammer fra. Kalsiumbikarbonat er ikke i fast tilstand, men i en vandig løsning, sammen med CA2+, Bikarbonat (HCO3-) og karbonationet (CO32-).
Deretter, ved å redusere karbondioksidmetning i vannet, oppstår den omvendte reaksjonen, det vil si transformasjonen av kalsiumbikarbonat til kalsiumkarbonat:
CA (HCO3)2(aq) => co2 (g) +h2Eller (l) +Caco3 (S)
Kalsiumkarbonat er lite oppløselig i vannet, dette fører til at nedbøren oppstår som et fast stoff. Den forrige reaksjonen er veldig viktig i dannelsen av stalaktitter, stalagmitter og annen tykkelse i hulene.
Disse steinete strukturene dannes fra vanndråpene som faller fra hulen i taket. Caco3 Til stede i vanndråpene krystalliseres for å danne de nevnte strukturer.
Det faktum å ikke finne kalsiumbikarbonat i fast tilstand har hindret bruken av det, og funnet få eksempler i denne forbindelse.
Struktur av kalsiumbikarbonat
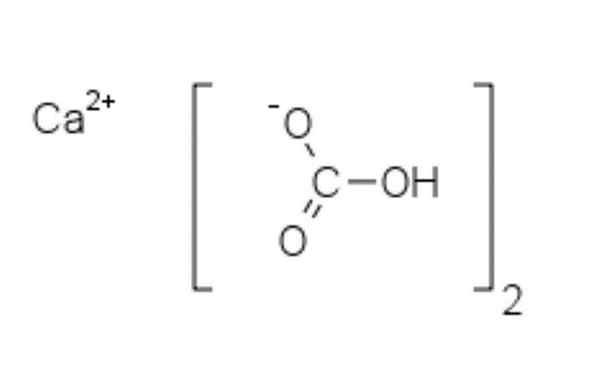 Kjemisk struktur av kalsiumbikarbonat
Kjemisk struktur av kalsiumbikarbonat I det øvre bildet vises to HCO -anioner3- og en CA -kation2+ samhandle elektrostatisk. Ca2+, I følge bildet skal det være plassert i midten, siden So HCO3- De ville ikke avvise hverandre for sine negative anklager.
Den negative belastningen i HCO3- Den flytter mellom to oksygenatomer, ved resonans mellom karbonyl C = O-gruppen og C-O-lenken-; mens i co32-, Dette flyttes mellom de tre oksygenatomene, siden C-O-bindingen er ubeskyttet og kan få en negativ resonansbelastning.
Det kan tjene deg: difenylaminGeometriene til disse ionene kan betraktes som kalsiumfærer omgitt av flate karbonattrekanter med en hydrogenert ende. Når det gjelder størrelsesforhold, er kalsium bemerkelsesverdig mindre enn HCO -ioner3-.
Vandige oppløsninger
Kalsiumbikarbonat Du kan ikke danne krystallinske faste stoffer, og det består virkelig av vandige oppløsninger av dette saltet. I dem er ionene ikke alene, som på bildet, men omgitt av H -molekyler2ENTEN.
Hvert ion er omgitt av en hydratiseringsfære, som vil avhenge av metall, polaritet og struktur av den oppløste arten.
Ca2+ Den koordinerer med oksygenatomene i vannet for å danne en akvemokompleks, CA (OH2)n2+, hvor n vanligvis anses å være seks; det vil si en "vandig oktaedron" rundt kalsium.
Mens HCO -anioner3- De samhandler godt, enten med hydrogenbroer (eller2Co-h-oh2) eller med hydrogenatomene i vannet i retning av den negative belastningen (hoco2- H-oh, dipolinteraksjon).
Disse interaksjonene mellom CA2+, HCO3- Og vann er så effektivt at de gjør kalsiumbikarbonat veldig løselig i det løsningsmidlet; I motsetning til kalsiumkarbonat (Caco3), der de elektrostatiske attraksjonene mellom CA2+ og co32- De er veldig sterke, og utfeller den vandige løsningen.
I tillegg til vann er det co -molekyler2 rundt, som reagerer sakte for å bidra med mer HCO3- (Avhengig av pH -verdier).
Hypotetisk faststoff
Så langt forklarer ionestørrelser og belastninger i kalsiumbikarbonat, og heller ikke tilstedeværelsen av vann, hvorfor det ikke er noen fast forbindelse; det vil si rene krystaller som kan karakteriseres av X -ray Crystallography. Kalsiumbikarbonat er ikke annet enn ioner som er til stede i vannet som de kavernøse formasjonene fortsetter å vokse.
Ja CA2+ og HCO3- De kunne isolere seg fra vannet og unngå følgende kjemiske reaksjon:
CA (HCO3)2(aq) → Caco3(S) + CO2(g) + h2Eller (l)
Da kan disse grupperes i et hvitt krystallinsk fast stoff med støkiometriske proporsjoner 2: 1 (2HCO3/1CA).
Kan tjene deg: 30 eksempler på kjemiske suspensjonerDet er ingen studier om strukturen, men den kan sammenlignes med den for natriumbikarbonat (som magnesiumbikarbonat, Mg (HCO3)2, Det eksisterer heller ikke som fast), eller med kalsiumkarbonat.
Stabilitet: natriumbikarbonat (Nahco3) Vs. Kalsiumbikarbonat (CA (HCO3)2)
Natriumbikarbonat krystalliseres i det monokliniske systemet, og kalsiumbikarbonat i trigonal (kalsitt) og Ortorrombic Systems (Aragonite).
Hvis na byttes ut+ for Ca2+, Det krystallinske nettverket vil bli destabilisert av større forskjell i størrelser; det vil si na+ For å være mindre danner det et mer stabilt glass med HCO3- Sammenlignet med CA2+.
Faktisk CA (HCO3)2(aq) trenger vann for å fordampe slik at ionene kan grupperes i et glass; Men det krystallinske nettverket av dette er ikke sterkt nok til å gjøre det ved romtemperatur. Når du varmer vannet, oppstår nedbrytningsreaksjonen (ligning ovenfra).
Å være ion na+ I løsning ville dette danne glasset med HCO3- Før den termiske nedbrytningen.
Årsaken til at kalsiumbikarbonat ikke krystalliseres (teoretisk), er på grunn av forskjellen på ioniske radioer eller størrelser på ionene deres, som ikke kan danne en stabil krystall før deres nedbrytning.
Kalsiumbikarbonat (CA (HCO3)2) vs. Kalsiumkarbonat (Caco3)
Hvis på den annen side, blir h lagt til+ Til de krystallinske strukturer av kalsiumkarbonat, ville de endre sine fysiske egenskaper drastisk. Kanskje faller smeltepunktene deres betydelig, og til og med morfologiene til krystallene endte endret.
Fysiske og kjemiske egenskaper
Kjemisk formel
CA (HCO3)2
Molekylær vekt
162.11 g/mol
Fysisk tilstand
Det vises ikke i fast tilstand. Det finnes i vandig løsning, og når varme påføres å fordampe, blir det kalsiumkarbonat.
Vannløselighet
16,1 g/100 ml ved 0º C; 16,6 g/100 ml ved 20 ºC og 18,4 g/100 ml ved 100 ºC.
Disse verdiene er en indikasjon på en stor affinitet av vannmolekylene av ionene av kalsiumbikarbonatet, som forklart i forrige seksjon. I mellomtiden oppløses bare 15 mg kalsiumkarbonat i en liter vann, noe som gjenspeiler dets sterke elektrostatiske interaksjoner.
Fordi kalsiumbikarbonat kan ikke danne et fast stoff, dets løselighet kan ikke bestemmes eksperimentelt.
Imidlertid gitt forholdene som er opprettet av CO2 Oppløst i vannet som omgir kalksteinen, kan massen av kalsium oppløst ved en T -temperatur beregnes; masse som vil være lik konsentrasjonen av kalsiumbikarbonat.
Kan tjene deg: Benzyic Acid: Syntese, Transposition and UsesVed forskjellige temperaturer øker den oppløste massen som vist i verdiene ved 0, 20 og 100 ºC. I følge disse eksperimentene bestemmes det hvor mye av kalsiumbikarbonat Det oppløses i nærheten av kalsiumkarbonat, i et vandig medium forgassifisert med CO2.
Når CO slipper ut2 Gassformig, kalsiumkarbonat vil presipitere, men ikke kalsiumbikarbonat.
Fusjons- og kokepunkter
Krystallnettet av CA (HCO3)2 Det er mye svakere enn Caco3. Hvis det kunne oppnås i en fast tilstand, og måle temperaturen som den smelter i en kilde, ville det sikkert oppnås en verdi godt under 899 ºC. På samme måte bør det samme forventes å bestemme kokepunktet.
Forbrenningspunkt
Det er ikke drivstoff.
Risiko
Siden denne forbindelsen ikke eksisterer solid, er det lite sannsynlig at den representerer en risiko for å manipulere de vandige oppløsningene, siden begge ionene CA2+ Som HCO3- De er ikke skadelige for lave konsentrasjoner; Og derfor kan den største risikoen, som vil være å innta slike løsninger, bare skyldes en farlig dose kalsium inntatt.
Hvis forbindelsen dannet et fast stoff, til og med fysisk forskjellig fra Caco3, Dets giftige effekter kunne ikke gå utover enkelt ubehag og reseksjon etter fysisk kontakt eller innånding.
applikasjoner
- Kalsiumbikarbonatløsninger har blitt brukt i lang tid for å vaske eldgamle artikler, spesielt kunstverk eller historisk viktige dokumenter.
- Bikarbonatløsninger har blitt brukt i forebygging av osteoporose. I ett tilfelle har imidlertid bivirkninger som hyperkalsemi, metabolsk alkalose og nyresvikt blitt observert i ett tilfelle.
- Kalsiumbikarbonat gis innimellom intravenøst for å korrigere den depressive effekten av hypokalemia på hjertefunksjon.
- Det brukes til å roe magesyring.
Referanser
- Wikipedia (2018). Kalsiumbikarbonat. Hentet fra: i.Wikipedia.org
- Sirah Dubois (3. oktober 2017). Hva er kalsiumbikarbonat? Gjenopprettet fra: Livestrong.com
- Science Learning Hub (2018). Karbonatkjemi. Gjenopprettet fra: Scientelarn.org.nz
- Pubchem (2018). Kalsiumbikarbonat. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov

