Natriumbisulfitt (NAHSO3) struktur, egenskaper, bruksområder, innhenting
- 1781
- 289
- Jonathan Carlsen
Han natriumbisulfitt Det er et uorganisk fast stoff dannet av et ion -natrium Na+ og en HSO bisulfittion3-. Den kjemiske formelen er Nahso3. Det er et krystallinsk hvitt faststoff, og for dets antioksidantegenskaper brukes mye som matkonserveringsmiddel (for eksempel i noen syltetøy).
Nahso3 Det er en reduserende kjemisk forbindelse, som er det motsatte av oksiderende, og av denne grunn fungerer det som en antioksidant i mange av bruksområdene, for eksempel spiselige produkter, siden det forhindrer at det er forverring.
 Noen kommersielle syltetøy inneholder nahso natriumbisulfitt3. Forfatter: OpenClipart-vektorer. Kilde: Pixabay.
Noen kommersielle syltetøy inneholder nahso natriumbisulfitt3. Forfatter: OpenClipart-vektorer. Kilde: Pixabay. Imidlertid har denne bruken blitt avhørt fordi astmasaker er rapportert hos personer etter at de har spist mat som inneholder natriumbisulfitt. Det sies til og med å ødelegge vitamin B1 av disse.
Internasjonale helseorganisasjoner har begrenset bruken til mikrokontiniteter i maten.
Imidlertid har natriumbisulfitt mange andre bruksområder, for eksempel å oppnå jod, som en anti -infeksjon, for å bleke vev, for fordøyelse av tre under fremstilling av papirmasse, som et desinfeksjonsmiddel av øl og vinfat osv.
[TOC]
Kjemisk struktur
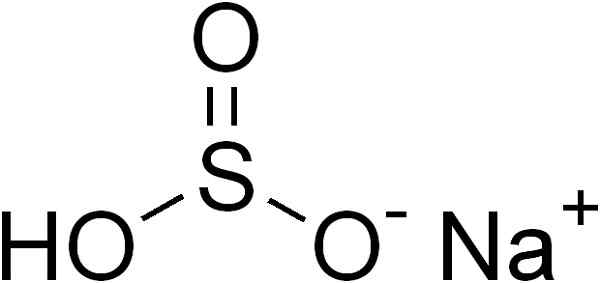
Natriumbisulfitt dannes ved en natriumna -kation+ og en HSO bisulfittanion3-.
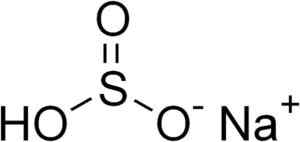 Kjemisk struktur av natriumbisulfitt3. Edgar181 [offentlig domene]. Kilde: Wikimedia Commons.
Kjemisk struktur av natriumbisulfitt3. Edgar181 [offentlig domene]. Kilde: Wikimedia Commons. I vandige oppløsninger danner bisulfitt 4 arter. I utvannet løsning er det en balanse mellom strukturene vist nedenfor:
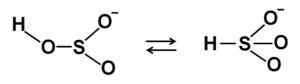 HSO bisulfittionstrukturer3- I fortynnet vandig løsning. Forfatter: Marilú Stea.
HSO bisulfittionstrukturer3- I fortynnet vandig løsning. Forfatter: Marilú Stea. Når konsentrasjonen øker to bisulfittmolekyler, interagerer med hverandre og danner pyrosulfittionene2ENTEN52-:
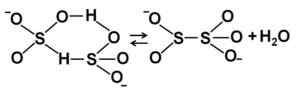 Bisulfittionstrukturer i konsentrert vandig løsning. Forfatter: Marilú Stea.
Bisulfittionstrukturer i konsentrert vandig løsning. Forfatter: Marilú Stea. Nomenklatur
-Natriumbisulfitt
-Natriumhydrogenosulfitt
-Natrium hydrosulfite.
Egenskaper
Fysisk tilstand
Krystallinsk hvitt fast stoff.
Molekylær vekt
104,06 g/mol
Smeltepunkt
Det dekomponerer.
Tetthet
1,48 g/cm3 ved 20 ºC.
Løselighet
Vannløselig: 29 g/100 g vann.
Ph
Løsningene er sure, med en pH mellom 2,5 og 5,5.
Kjemiske egenskaper
I vandig løsning natriumbisulfitt3 skilles inn i ionene: natriumkationen na+ og HSO -bisulfittanionen3-.
Hvis natriumbisulfitt blir utsatt for luft, mister noen så2 og oksiderer sakte sulfat2SW4.
Det kan tjene deg: Gallinsyre: Struktur, egenskaper, innhenting, brukHvis det blir oppvarmet til nedbrytningen hans avgir svoveloksider og natriummonoksid.
Det er et reduserende middel, som er det motsatte av oksidant. Og av denne grunn kan det oppføre seg som antioksidant.
Den har en liten lukt av svovel. Det er ikke brannfarlig.
Risiko
Nahso natriumbisulfitt3 Det er et sterkt skinn- og vevsirriterende. Støvet irriterer øynene, nesen og halsen. Ved inntak irriterer magen. Store doser kan forårsake voldelige kramper, diaré, depresjon og død.
Det er ikke drivstoff, men det er oppvarmet produserer irriterende og giftige gasser.
Å skaffe
Det tilberedes ved å mette en natriumkarbonatoppløsning Na2Co3 Med svoveldioksid så2 og krystalliserer seg i løsningen.
applikasjoner
I masse- og papirindustrien
Nahso3 Det brukes i fordøyelsen av treverket, slik at det deretter kan bli papir. Det fungerer også som masse hvitere.
Det brukes også til å eliminere klor når papirmassen er blitt bleket med dette.
I matindustrien
Natriumbisulfitt for sin reduserende eiendom fungerer som en antioksidant.
Det brukes som konserveringsmiddel i en stor mengde mat og drikke, inkludert vin og øl, for å forhindre at dens forverring og forbedrer smaken.
Det tjener til å bleke mat, for eksempel visse spiselige stivelser.
Det reduserer eller forhindrer forverring av mat, gjør at deigen brukes i bakt mat og serverer å myke maiskorn under våt sliping, blant annet bruk.
I tillegg til å kontrollere gjæringen av vin og øl, fungerer den som et antiseptisk middel i sin utdyping fordi det fungerer som sterilisering og soppmiddel i fat og teiner.
 Vin- eller ølfat blir noen ganger desinfisert med natriumbisulfitt3. Forfatter: Clker-Free-Vector-Image. Kilde: Pixabay.
Vin- eller ølfat blir noen ganger desinfisert med natriumbisulfitt3. Forfatter: Clker-Free-Vector-Image. Kilde: Pixabay. I tørket frukt er det i konsentrasjoner over 100 ppm (ppm betyr "deler per million"), i mange andre matvarer er det i konsentrasjoner mellom 10 og 100 ppm, for eksempel frosne og tørre poteter, sylteagurk, sauser og syltetøy.
 Kommersiell syltet mat inneholder ofte Nahso natriumbisulfitt3. Forfatter: fotomiks. Kilde: Pixabay.
Kommersiell syltet mat inneholder ofte Nahso natriumbisulfitt3. Forfatter: fotomiks. Kilde: Pixabay. Kontrovers om bruken av maten
Det har vært en viss bekymring for de giftige effektene både øyeblikkelig og lang satriumbisulfitt i mat. Det er forskjellige meninger.
Kan tjene deg: kaliumferrocyanidDet er rapporter om bivirkninger av pasienter med astma, som er en luftveissykdom, etter inntak av dagligvarer med NAHSO3. Andre kilder indikerer at bisulfittionet kan ødelegge vitamin B1 eller tiamin.
 Jente som håper en medisin for å lindre astma. Forfatter: OpenClipart-vektorer. Kilde: Pixabay.
Jente som håper en medisin for å lindre astma. Forfatter: OpenClipart-vektorer. Kilde: Pixabay. Imidlertid fant visse forskere i 1985 at natriumbisulfitt tjener til å beskytte mot kjemiske midler, og hemmer eller forhindrer transformasjon av celler til kreft. De lave dosene er de beste.
Denne beskyttende effekten er blitt forklart basert på dens reduksjons- eller antioksidantegenskaper, og at på denne måten kan angripe frie radikaler.
På den annen side, Verdens helseorganisasjon, eller hvem (for forkortelsen for engelsk Verdens helseorganisasjon), anbefaler som et akseptabelt nivå av daglig inntak omtrent 0,7 mg/kg av personen.
Det betyr at det anbefales å ikke overstige det beløpet.
Food and Medicine Administration of the United States, eller USFDA (engelsk akronym US Food and Drug Administration), klassifiserte han natriumbisulfitt som "generelt anerkjent som forsikring".
I landbruksapplikasjoner
Brukt i lave konsentrasjoner NAHSO3 Det fungerer som en plantevekstregulator, for å forbedre fotosyntesen og fremme avlingsytelse.
Dette målet er testet i forskjellige typer planter som jordbær- og teplanter.
 Jordbærplanter forbedrer ytelsen med små mengder Nahso3 I vanningsvann. Forfatter: Alyssapy. Kilde: Pixabay.
Jordbærplanter forbedrer ytelsen med små mengder Nahso3 I vanningsvann. Forfatter: Alyssapy. Kilde: Pixabay. Det er den aktive ingrediensen i mange plantevernmidler og biocider.
I vannmiljøer kan det også akselerere transformasjonen av visse ugressmidler til mindre giftige produkter ved å eliminere klor.
Ved å skaffe jod
Nahso3 Det er den reduserende forbindelsen som brukes til å frigjøre jodinus av natrium NAIO3. Dette er en av måtene å få jod fra kilder som det chilenske nitroen eller noen Salinas farvann.
Etter å ha krystallisert natriumnitratet til nitratoppløsningen av grov chile, er det en NAIO -løsning3 som blir behandlet med natriumbisulfitt3, generere gratis jod.
2 Naio3 + 5 Nahso3 → 3 nahso4 + Na2SW4 + Yo2
I møbler og treindustri
Nahso3 Det er testet for å modifisere soyaproteiner og forbedre vedheftelsesegenskapene med tre med sikte på å lime inn trebiter fra hverandre for å tilberede for eksempel agglomerater, trepapp eller steinpapp, tellerformet osv. Alt for møbler eller brett, blant flere applikasjoner.
Det kan tjene deg: litiumhydroksid (LIOH) Agglomerat av splinter eller trestøtter. Forfatter: Titus Tschardke [Public Domain]. Kilde: Wikimedia Commons.
Agglomerat av splinter eller trestøtter. Forfatter: Titus Tschardke [Public Domain]. Kilde: Wikimedia Commons. Dette gjøres for å erstatte tradisjonelle lim basert på formaldehyd fordi både i produksjonsprosessen og under bruk har en tendens til å fritt formalisere atmosfæren, som er en giftig forbindelse.
Natriumbisulfitt forbedrer det faste innholdet i soyaproteinlimet, og reduserer viskositeten til dette forbedrer det.
Soyaproteinlim modifisert med NAHSO3 Den har god vannmotstand og utmerket lagringsstabilitet på grunn av antioksidantvirkningen av natriumbisulfitt.
Dette bekrefter at modifiserte soyaproteinlim med NAHSO3 De er sammenlignbare med lim basert på formaldehyd og kan brukes i møbler og treindustrien, og er mindre forurensende.
I forskjellige applikasjoner
Den har flere bruksområder, vanligvis basert på dens reduserende egenskaper (som er det motsatte av oksidant). Her er noen applikasjoner.
-I fotografering.
-I læretanneren, for å fjerne hår fra skinnene.
-Terapeutiske bruksområder: Anti -infektious. Det brukes som antioksidant i noen få dråper for -ojos.
-I naturgassekstraksjon ved hydraulisk brudd.
-I fiberfarging brukes det til fremstilling av bad eller kaldt badekar, for å solubilisere visse fargestoffer eller fargestoffer.
-Som en reduksjon i klesvask eller bleking, til blekingsull, silke og plantefibre.
-I kjemilaboratorier for å fjerne hud- og klær flekker. I biokjemi laboratorier som et flytende konserveringsmiddel eller løsninger som kan forverres over tid. Som et kjemisk reagens.
-For gummilatexkoagulering.
-I kosmetikkindustrien som antioksidant.
-Desinfeksjonsmiddel og blekemiddel.
-I avløpsvannbehandling for å eliminere klor brukt i sluttfasen av desinfeksjon og kunne laste ned vannet som allerede er behandlet til miljøet.
 Natriumbisulfitttank i et renseanlegg i California, hvor det brukes til å eliminere overflødig klor før renset vann lastes ned til miljøet. Grendelkhan [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Natriumbisulfitttank i et renseanlegg i California, hvor det brukes til å eliminere overflødig klor før renset vann lastes ned til miljøet. Grendelkhan [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Referanser
- ELLER.S. National Library of Medicine. (2019). Natriumbisulfitt. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Qi, g. et al. (2013). Adhesjon og fysisk -kjemiske egenskaper ved SER -protein modifisert ved natriumbisulfitt. J Am Oil Chem Soc (2013) 90: 1917-1926. Gjenopprettet fra AOCs.Online bibliotek.Wiley.com.
- Borek, c. et al. (1985). Natriumbisulfitt beskytter mot radiogogen og kjemisk indusert transformion i hamsterembryo og mus C3H/10T-1/2-celler. Toxicol Ind Health 1985Sep; 1 (1): 69-74. Gjenopprettet fra tidsskrifter.Sagepub.com.
- Friedler, e. et al. (2015). En kontinuerlig aktiv overvåkningstilnærming for å identifisere kryssforbindelser mellom drikkevann og distribusjonssystemer. Miljømonitvurdering (2015) 187: 131. Lenke gjenopprettet.Springer.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Sunnyvale Cleanwater Program. (2019). Vannforurensningskontroll Plant Master Plan. Gjenopprettet fra Sunnyvalecleanwater.com.
- Barros Santos, C. (2008). Tilsetningsstoffer i fôring av spanjolene og lovgivningen som regulerer deres autorisasjon og bruk. Books Vision. Gjenopprettet fra bøker.Google.co.gå.

