Kaliumnatriumpumpestruktur, funksjon, mekanisme, betydning
- 4809
- 1195
- Jonathan Moe
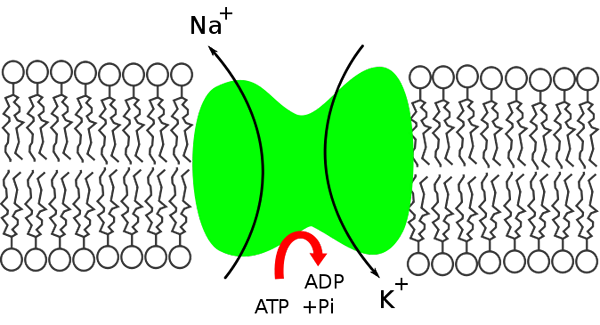
De Kaliumnatriumbombe Det er en proteinstruktur inkludert i et bredere sett med molekyler som er til stede i mange cellemembraner, og som er ansvarlige for aktiv transport av ioner eller andre små molekyler mot konsentrasjonsgradienter. De bruker energien som frigjøres av ATP -hydrolyse, og det er derfor de generisk kalles atasas.
Kaliumnatriumpumpen er en Na+/K+ATPay fordi den frigjør energien som finnes i ATP -molekylet for å bevege natrium inne i cellen, og introduserer samtidig kalium.
 Kaliumnatriumbombeopplegg. Ytre og indre av cellen. (Kilde: Miguelferig, via Wikimedia Commons)
Kaliumnatriumbombeopplegg. Ytre og indre av cellen. (Kilde: Miguelferig, via Wikimedia Commons) Inne i cellen er natriumet mindre konsentrert (12 mEq/L) enn utenfor (142 mEq/L), mens kalium er mer konsentrert utenfor (4 meq/l) enn inne (140 mEq/L).
Atasas -bomber er klassifisert i tre store grupper:
- Ioniske pumper av type F og V: De er ganske komplekse strukturer, de kan bestå av 3 forskjellige typer transmarkedunderenheter og opptil 5 tilknyttede polypeptider i cytosol. De fungerer som protontransportører.
- ABC Superfamily (av engelsk TILTp-BInnlever CAssette = ATP Union Cassette): Integrert av mer enn 100 proteiner som kan fungere som ionetransportører, monosakkarider, polysakkarider, polypeptider og til og med andre proteiner.
- Ioniske pumper i klasse P: dannet av minst en transmembraal alfa -katalytisk underenhet som har et unionssted for ATP og en mindre β -underenhet. Under transportprosessen er α -underenheten Phosphoryila og derav navnet "P".
Kaliumnatrium (Na+/K+ATPASA) -bomben tilhører den ioniske pumpegruppen i klasse P og ble oppdaget i 1957 av Jens Skou, en dansk forsker, da han studerte virkningsmekanismen til anestesi i nervene til en krabbe (Carcinus Maenas); Arbeid som Nobelprisen i kjemi ble tildelt i 1997.
 Kaliumnatriumbombe. Nakpompe2.JPG: Phi-gastrein ved kulde.Wikipediaderivativt arbeid: Sonia/CC BY-S (http: // CreativeCommons.Org/lisenser/by-SA/3.0/)
Kaliumnatriumbombe. Nakpompe2.JPG: Phi-gastrein ved kulde.Wikipediaderivativt arbeid: Sonia/CC BY-S (http: // CreativeCommons.Org/lisenser/by-SA/3.0/) [TOC]
Kaliumnatriumpumpestruktur
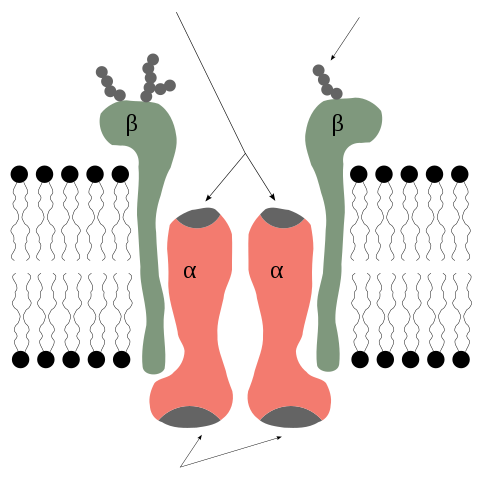
Kaliumnatriumpumpen er et enzym som fra synspunktet av dens kvartære struktur dannes av 2 ALFA (α) proteinunderenheter og to betatype (β).
Det er derfor en α2β2 -tetramer, hvis underenheter er omfattende membranproteiner, det vil si at de krysser lipid -dobbeltlaget og har både intra og ekstra cytosoliske domener.
 Alfa- og beta -underenheter av kaliumpumpen. Rob Cowie/CC By-SA (http: // CreativeCommons.Org/lisenser/by-SA/3.0/)
Alfa- og beta -underenheter av kaliumpumpen. Rob Cowie/CC By-SA (http: // CreativeCommons.Org/lisenser/by-SA/3.0/) Alfa -undermunitet
Α -underenhetene er de som inneholder unionsstedene for ATP og for Na+ og K+ -ionene og representerer den katalytiske komponenten i enzymet og den som utøver funksjonen til selve bomben i seg selv.
Α-underenhetene er polypeptider i stor størrelse, med en molekylvekt på 120 kDa, 10 transmembranalsegmenter og med deres N-og C-terminale ender plassert på den cytosoliske siden.
De har på de intracellulære sideforeningsstedene for ATP og for Na+, samt en aspartatrester i posisjon 376 som representerer stedet som ble påført fosforyleringsprosessen under aktiveringen av pumpen.
Bindingsstedet for K+ er tilsynelatende på den ekstracellulære siden.
Beta -underenheter
Β -underenhetene ser ikke ut til å ha en direkte deltakelse i pumpefunksjonen, men i deres fravær forekommer ikke funksjonen.
Β -underenhetene har en molekylvekt på omtrent 55 kDa hver og er glykoproteiner med et enkelt transmarkedsdomene hvis glukidavfall settes inn i det ekstracellulære området.
Kan tjene deg: Basalark: Karakteristikker, histologi og funksjonerDe ser ut til å være nødvendige i endoplasmatisk retikulum, hvor de vil bidra til riktig folding av α -underenhetene, og deretter på membranens nivå for å stabilisere komplekset.
Begge typer underenheter er heterogene og er beskrevet så langt α1, α2 og α3 isoformer for UNA, og β1, β2 og β3 for den andre. Α1 finnes i membranene i de fleste celler, mens α2 er til stede i muskel, hjerte, fettvev og hjerne og α3 i hjerte og hjerne.
Β1 -isoformen er den mest diffuse fordelingen, selv om den er fraværende i noen vev som vestibulære celler i det indre øret og hurtigresponsen glykolytiske muskelceller. Sistnevnte inneholder bare β2.
De forskjellige strukturene i underenhetene som utgjør Na+/K+ -pumpen i de forskjellige vevene, kan adlyde spesialiseringer av en funksjonell type, men likevel belyst.
Kaliumpumpefunksjon
For enhver tid som vurderes, utgjør plasmamembranen en separasjonsgrense mellom det tilsvarende rommet til det indre av en celle og den som representerer den ekstracellulære væsken der den er nedsenket.
Begge rommene har en sammensetning som kan være kvalitativt forskjellige, siden inne i cellene er det stoffer som ikke er ute av dem og den ekstracellulære væsken inneholder stoffer som ikke er tilstede intracellularly.
Stoffer som er til stede i begge rommene kan finnes i forskjellige konsentrasjoner, og disse forskjellene kan ha en fysiologisk betydning. Slik er tilfellet med mange ioner.
Homeostase vedlikehold
Na+/K+ -pumpen oppfyller en grunnleggende funksjon i opprettholdelsen av intracellulær homeostase ved å kontrollere natrium- og kaliumionkonsentrasjoner. Dette vedlikeholdet av homeostase oppnår det takket være:
- Ionetransport: Introduserer natriumioner og utvider kaliumioner, og prosesser der det også fremmer bevegelsen av andre molekyler gjennom andre transportører som er avhengige av den elektriske ladningen eller den indre konsentrasjonen av disse ionene.
- Cellevolumkontroll: Introduksjonen eller utgangen av ioner innebærer også tannbevegelser i cellen, så pumpen deltar i cellevolumkontroll.
- Membranpotensialgenerering: Utvisning av 3 natriumioner for hver 2 kaliumioner som blir introdusert forårsaker membranen. Denne forskjellen er kjent som hvilepotensial.
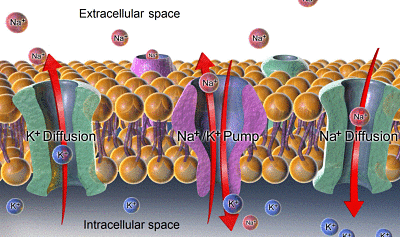
Na+ har en ekstracellulær konsentrasjon på omtrent 142 mEq/L, mens dens intracellulære konsentrasjon bare er 12 mEq/L; K+, derimot, er mer konsentrert i cellen (140 mEq/L) enn utenfor den (4 meq/l).
Selv om den elektriske ladningen til disse ionene ikke tillater deres passasje gjennom membranen, er det ioniske kanaler som tillater den (selektivt), som favoriserer bevegelsen hvis kreftene som vanligvis beveger disse ionene også er til stede.
Kan tjene deg: Membranreseptorer: funksjoner, typer, hvordan de fungererNå har disse konsentrasjonsforskjellene stor betydning i Bevaring av homeostase av organismen og må opprettholdes i en slags balanse som vil gå tapt.
 Formidling og kaliumnatrium (kilde: Bruceblaus. Når du bruker dette bildet i eksterne kilder, kan det siteres som: blausen.Com Staff (2014). "Medical Gallery of Blausen Medical 2014". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.010. ISSN 2002-4436.Derivat av Mikael Häggström/cc av (https: // creativecommons.Org/lisenser/av/3.0) via Wikimedia Commons)
Formidling og kaliumnatrium (kilde: Bruceblaus. Når du bruker dette bildet i eksterne kilder, kan det siteres som: blausen.Com Staff (2014). "Medical Gallery of Blausen Medical 2014". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.010. ISSN 2002-4436.Derivat av Mikael Häggström/cc av (https: // creativecommons.Org/lisenser/av/3.0) via Wikimedia Commons) - Konsentrasjonsforskjellen for Na+ mellom interiøret og utenfor cellen skaper en kjemisk gradient som skyver natrium innover og gjør at dette ionet hele tiden kommer inn og spotte for å spre den forskjellen, det vil si å matche konsentrasjonene i begge sider.
- Kaliumgradienten opprettholdes i motsatt retning, det vil si fra innsiden og ut, slik at den konstante utgangen til ionet og dens interne reduksjon og eksterne økning.
Funksjonen til Na+/K+ -pumpen gjør det.
Mekanisme (prosess)
Handlingsmekanismen til ATPase Na+/K+ består av en katalytisk syklus som innebærer overføringsreaksjoner fra en fosforyl (PI) gruppe og konformasjonsendringer av enzymet som passerer fra en tilstand E1 til en E2 -tilstand og omvendt.
Operasjonen krever tilstedeværelse av ATP og Na+ inne i cellen og K+ i den ekstracellulære væsken.
Union av natriumioner til transportøren
Syklusen begynner i konformasjonstilstanden E1 i enzymet, der det er 3 cytosoliske steder med Na+ union og høy affinitet (km på 0,6 mm) som er fullt okkupert fordi intra -konsentrasjonen av ionet (12 mM) tillater det.
ATP -hydrolyse
I denne tilstanden (E1) og med Na+ festet til unionsstedene, er ATP festet til sitt sted i den cytosoliske sektoren av molekylet, en fosfatgruppe til 376 aspartat overføres og overføres, og danner en høy energi -acilfosfat som induserer en konformasjonsendring til staten E2.
Utvisning av 3 natriumioner og introduksjon av 2 kaliumioner
Konformasjonsendringen til E2 -staten innebærer at Na+ -foreningsstedene går til i utlandet, deres tilhørighet til ionet avtar mye og frigjøres i den ekstracellulære væsken, samtidig Og disse ionene binder seg til pumpen.
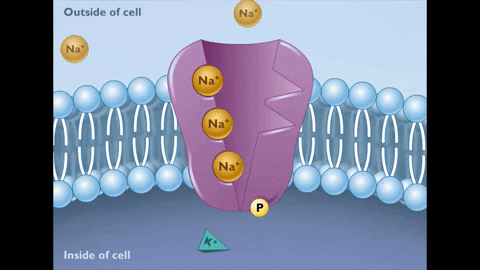 Under tilstanden E2 frigjøres ionene til Na+ på den andre siden av membranen.
Under tilstanden E2 frigjøres ionene til Na+ på den andre siden av membranen. 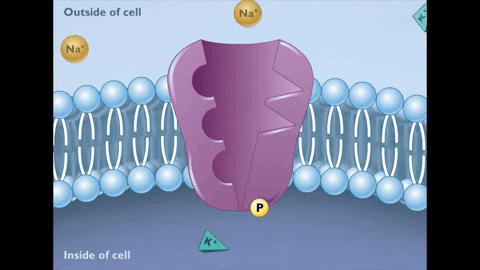 På sin side genererer denne nye tilstanden til pumpen affinitet for foreningen av K -ioner+
På sin side genererer denne nye tilstanden til pumpen affinitet for foreningen av K -ioner+ Reversering fra E2 til E1
Når Na+ er utgitt og K+ er forent, produseres hydrolysen av aspartilfosfat.
Når denne endringen skjer, kan stedene for Na+ gjenopprette sin affinitet og de av K+ mister den, som K+ frigjøres inne i cellen.
Betydning
I vedlikehold av celle osmolaritet
Na+/K+ -bomben har vært til stede i de fleste, om ikke i alt.
Kan tjene deg: Peroxidases: Struktur, funksjoner og typerDen kontinuerlige innføringen av natriumioner i cellen kondisjonerer en økning i det intracellulære antallet osmotisk aktive partikler, noe som induserer vanninntreden og økningen i volum som vil ende opp med å forårsake brudd på membranen og cellen kollaps.
I dannelsen av membranpotensialet
Ettersom disse pumpene bare introduserer 2 K+ for hver 3. Na+ de tar ut, oppfører de seg elektrogenisk, noe som betyr at de "dekompenserer" interne elektriske ladninger, og favoriserer produksjonen av det karakteristiske membranpotensialet til kroppsceller.
Dets betydning er også tydelig i forhold til cellene som utgjør de spennende vevene, der handlingspotensialene er preget av inntreden av Na+-ionen, som depolariserer cellen, og utgangen fra K+, som repolariserer den.
Disse ioniske bevegelsene er mulig takket være driften av Na+/K+-pumper, som bidrar til produksjon av kjemiske gradienter som beveger de involverte ionene.
Uten disse pumpene, som fungerer i motsatt retning, ville konsentrasjonsgradientene til disse ionene forsvinne og den eksitatoriske aktiviteten ville forsvinne.
I nyrefunksjon
Et annet aspekt som fremhever den ekstreme viktigheten av natrium-potassiumbomber er i forhold til nyrefunksjon, noe som ikke ville være umulig.
Nyrefunksjonen innebærer daglig filtrering av mer eller mindre 180 liter plasma og store mengder stoffer, hvorav noen må skilles ut, men mange må reabsorberes slik at de ikke går tapt i urinen.
Resorpsjonen av natrium, vann og mange av de filtrerte stoffene avhenger av disse pumpene, som er lokalisert i den basolaterale membranen til cellene som utgjør epitelen til de forskjellige rørformede segmentene i nyrenes nefroner.
Epitelcellene som polerer nyretubuli har et ansikt som er i kontakt med lyset fra tubulen, og som kalles det apikale ansiktet, og en annen som er i kontakt med interstitium rundt tubulen og kalt basolateral.
Vannet og stoffene som er reabsorb må først passere inn i det indre av cellen gjennom apikalen og deretter til interstitium av basolateral.
Reabsorpsjonen av Na+ er nøkkelen både i forhold til ham, og i forhold til vannet og den til andre stoffer som er avhengige av hans. Den apikale oppføringen av Na+ cellen krever at det er en gradient som beveger den, og som innebærer en veldig lav konsentrasjon av ionet inne i cellen.
Denne lave intracellulære konsentrasjonen av Na+ produseres av natriumpumper fra den basolaterale membranen som fungerer intenst for å fjerne ionet fra cellene til interstitium.
Referanser
- Ganong WF: Det generelle og cellulære grunnlaget for medisinsk fysiologi, i: Gjennomgang av medisinsk fysiologi, 25. utg. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JI: Stofftransport over cellemembranen, i: Lærebok for medisinsk fysiologi, 13. utg, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J: Transport over cellemembranene, i: Molecular and Cell Biology, 4. ed.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger prinsipper for biokjemi. Macmillan.
- Alberts, f., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, P. (2013). Essensiell cellebiologi. Garland Science.
- « SOMA -egenskaper deler og funksjoner
- Mayates (cotinis mutabilis) egenskaper, habitat, reproduksjon »

