Aluminium karbonatstruktur, egenskaper, bruker
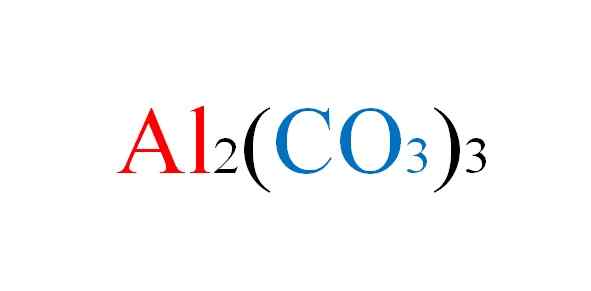
- 3653
- 719
- Dr. Andreas Hopland
Han Aluminiumkarbonat Det er et uorganisk salt hvis kjemiske formel er2(Co3)3. Det er et praktisk talt ikke -eksisterende metallkarbonat, gitt dets høye ustabilitet under normale forhold.
Blant årsakene til ustabiliteten kan vi nevne de svake elektrostatiske interaksjonene mellom ionene til3+ og co32-, som i teorien skal være veldig sterk for størrelsene på belastningen.
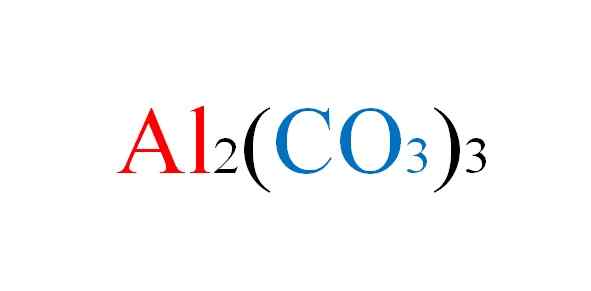 Aluminiums karbonatformel. Kilde: Gabriel Bolívar.
Aluminiums karbonatformel. Kilde: Gabriel Bolívar. Salt står overfor eventuelle ulemper i papiret når de kjemiske ligningene av reaksjonene deres er skrevet; Men i praksis er det imot det.
Til tross for det som ble sagt, kan aluminiumkarbonat oppstå i selskap med andre ioner, som tilfellet er med Dawsonite -mineralet. Det er også et derivat der det samhandler med den vandige ammoniakk. Av resten regnes det som en blanding mellom Al (OH)3 og h2Co3; som er lik en sprudlende løsning med et hvitt bunnfall.
Denne blandingen har medisinsk bruk. Imidlertid til det rene, isolerbare og manipulerbare saltet av Al2(Co3)3, Du er ikke kjent mulige applikasjoner; I det minste ikke lave store trykk eller ekstreme forhold.
[TOC]
Aluminiumkarbonatstruktur
Den krystallinske strukturen for dette saltet er ukjent, fordi det er så ustabilt at det ikke har vært i stand til å bli karakterisert. Fra sin formel til2(Co3)3, Det er imidlertid kjent at andelen ioner til3+ og co32- Det er 2: 3; det vil si at for hvert to kationer til2+ Det må være tre anioner co32- samhandle elektrostatisk med dem.
Problemet er at begge ionene er veldig ulik når det gjelder størrelsene deres; Al3+ Det er veldig lite mens CO32- Det er klumpete. Denne forskjellen i seg selv påvirker allerede den retikulære stabiliteten til det krystallinske nettverket, hvis ioner vil samhandle "tafatt" hvis dette saltet i fast tilstand er isolert.
Det kan tjene deg: Avogadro -nummer: Historie, enheter, hvordan det beregnes, brukerI tillegg til dette aspektet, Al3+ Det er en svært polariserende kation, egenskap som deformerer den elektroniske skyen til CO32-. Det er som om han ønsket å tvinge ham til å koble kovalent, selv om anionen ikke kan gjøre det.
Følgelig ioniske interaksjoner mellom Al3+ og co32- De har en tendens til kovalens; En annen faktor som øker ustabiliteten til Al2(Co3)3.
Hydroksyd karbonat aluminium ammonium
Det kaotiske forholdet mellom Al3+ og co32- Det mykner i utseendet når det er andre ioner som er til stede i glasset; som NH4+ Og åh-, fra en ammoniakkløsning. Denne ionekvartetten, til3+, Co32-, NH4+ Og åh-, De klarer å definere stabile krystaller, til og med i stand til å ta i bruk forskjellige morfologier.
Et annet eksempel som ligner på dette observeres i Dawsonite -mineralet og dets ortorrombiske krystaller, Naalco3(ÅH)2, Hvor na+ Bytt ut NH4+. I disse saltene er deres ioniske bindinger sterke nok til at vann ikke fremmer frigjøring av CO2; eller i det minste ikke brått.
Selv om NH4Al (å)2Co3 (AACC, for sine sigler på engelsk), og heller ikke naalco3(ÅH)2 De representerer aluminiumkarbonat, de kan betraktes som grunnleggende derivater av det samme.
Egenskaper
Molmasse
233,98 g/mol.
Ustabilitet
I forrige seksjon ble det forklart fra et molekylært perspektiv hvorfor Al2(Co3)3 Det er ustabilt. Men hvilken transformasjon lider det? Du må vurdere to situasjoner: en tørr, og den andre "våte".
Tørke
I den tørre situasjonen er anionen CO32- CO er reversert2 Gjennom følgende nedbrytning:
Til2(Co3)3 => Al2ENTEN3 + 3CO2
Det kan tjene deg: kalsiumfosfat (CA3 (PO4) 2)Noe som er fornuftig hvis det blir syntetisert under aluminiumoksyd til stort trykk av CO2; det vil si den omvendte reaksjonen:
Til2ENTEN3 + 3CO2 => Al2(Co3)3
Derfor, for å unngå å dekomponere AL2(Co3)3 Du må sende inn salt til stort trykk (ved hjelp av n2, For eksempel). På denne måten dannelsen av CO2 ville ikke være termodynamisk foretrukket.
Våt
Mens du er i den våte situasjonen, CO32- Det lider av hydrolyse, som genererer små mengder OH-; Men nok til at aluminiumhydroksyd kan utfelle, ved (OH)3:
Co32- + H2Eller HCO3- + Åh-
Til3+ + 3OH- Al (å)3
Og på den annen side, Al3+ Det er også hydrolysert:
Til3+ + H2Eller til (å)22+ + H+
Selv om det virkelig ville være hydrert3+ Å danne komplekset til (h2ENTEN)63+, som er hydrolysert for å gi [til (h2ENTEN)5Åh]2+ og h3ENTEN+. Deretter, h3Eller (eller h+) Protona til CO32- til h2Co3, som bryter sammen til CO2 og h2ENTEN:
Co32- + 2H+ => H2Co3
H2Co3 Co2 + H2ENTEN
Legg merke til at til slutt Al3+ Det oppfører seg som en syre (frigjør h+) og en base (slipp oh- Med balansen mellom løselighet av Al (OH)3); det vil si at den viser amfoterisme.
Fysisk
For å kunne isolere seg, vil dette saltet sannsynligvis være hvitt, som mange andre aluminiumsalter. På grunn av forskjellen mellom de ioniske radioene til Al3+ og co32-, Sikkert ville det ha veldig lave smelte- eller kokepunkter sammenlignet med andre ioniske forbindelser.
Det kan tjene deg: Benchilo: Benzylhydrogener, karbokasjoner, benzylradikalerOg når det gjelder løseligheten, ville det være uendelig løselig i vann. I tillegg ville det være et hygroskopisk og deilig fast stoff. Dette er imidlertid bare formodninger. Andre egenskaper må estimeres med beregningsmodeller underlagt høyt trykk.
applikasjoner
Bruksområdene som er kjent fra aluminiumkarbonat er medisinsk. Det ble brukt som et mykt snerpende og som et medikament for å behandle betennelse og magesår. Det har også blitt brukt for å forhindre dannelse av urinberegninger hos mennesker.
Det har blitt brukt til å kontrollere en økning i kroppsinnhold i fosfat og også for å behandle magesyresymptomer, syrefordøyelse og magesår.
Referanser
- Xuehui l., Zhe t., Yongming c., Ruiyu z. & Chenguang l. (2012). Hydrotermisk syntese av ammoniumaluminiumkarbonathydroksyd (AACH) nanoplateletter og nanofibre PH-kontrollerte morfologier. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammonium aluminium karbonathydroksyd NH4AL (OH) 2CO3 som en alternativ rute for aluminiumpreparat: sammenligning med den klassiske buehmitt -presuroror. Powder Technology, 320, 565-573, DOI: 10.1016/j.Powec.2017.07.0080
- Nasjonalt senter for bioteknologiinformasjon. (2019). Aluminiumkarbonat. PubChem -database., CID = 1035396. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Aluminiumkarbonat. Hentet fra: i.Wikipedia.org
- Aluminumsulfat. (2019). Aluminiumkarbonat. Gjenopprettet fra: aluminumsulfat.nett

