Kaliumkarbonat (K2CO3) struktur, egenskaper, bruk, oppnåelse

- 1107
- 68
- Thomas Karlsen
Han Kaliumkarbonat Det er en uorganisk forbindelse dannet av to kaliumioner k+ og et kullion co32-. Den kjemiske formelen er k2Co3. Det er et hygroskopisk hvitt fast stoff, det vil si at det lett absorberer vannet fra miljøet. Derfor brukes det i laboratorier til å absorbere vann fra andre stoffer.
Det er veldig løselig i vanndannende alkaliske løsninger, som er rike på OH -ioner-og derfor med en høy pH -verdi. Dens vandige oppløsninger, fordi de er alkaliske, brukes i flere industrielle prosesser for å absorbere syregasser som karbondioksid2 og hydrogensulfid H2S, nøytraliserer dem lett lett.
 Kaliumkarbonat k2Co3 fast. Ondřej Mangl [Public Domain]. Kilde: Wikimedia Commons.
Kaliumkarbonat k2Co3 fast. Ondřej Mangl [Public Domain]. Kilde: Wikimedia Commons. K2Co3 Det brukes til å tilberede såper, rengjøringsprodukter, vaskemidler for å vaske klær og blandinger for å vaske oppvasken. Det brukes også i behandlingen av noen tekstilfibre som ull.
Det er mye brukt i kjemilaboratorier, for eksempel for å absorbere vann fra andre forbindelser eller for å alkalisere blandinger av kjemiske reaksjoner og også i kjemisk analyse.
Det er også lagt til noen matvarer, for eksempel for å eliminere den bitre smaken av kakaofrø under sjokoladeproduksjon.
[TOC]
Struktur
Kaliumkarbonat består av to kalium K -kationer+ og et karbonatanion co32-. Karbonatanionen har en flat og symmetrisk struktur, mens de tre oksygenatomene omgir karbon som danner en flat trekant.
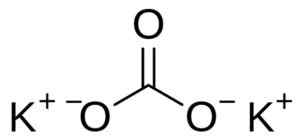 Kaliumkarbonatstruktur k2Co3. Bruker: Edgar181 [Public Domain]. Kilde: Wikimedia Commons.
Kaliumkarbonatstruktur k2Co3. Bruker: Edgar181 [Public Domain]. Kilde: Wikimedia Commons. Nomenklatur
- Kaliumkarbonat
- Kaliumkarbonat
- Dipotasiumkarbonat
- Potash
- Kullsyre kaliumsalt.
Egenskaper
Fysisk tilstand
Krystallinsk fargeløs til hvit.
Molekylær vekt
138,205 g/mol.
Smeltepunkt
899 ºC.
Kokepunkt
Det dekomponerer.
Tetthet
2.29 g/cm3
Løselighet
Veldig løselig i vann: 111 g/100 g vann ved 25 ° C. Uoppløselig i etanol og aceton.
Kan tjene deg: bidrag fra kjemi til medisinPh
En vandig løsning kan ha en pH på 11,6, det vil si at den er ganske alkalisk.
Kjemiske egenskaper
Kaliumkarbonat er delikat eller hygroskopisk, det vil si at det absorberer miljøet i miljøet. Den har et stabilt hydrat, k2Co3.2H2ENTEN.
K2Co3 I vandig løsning er det hydrolysert, det vil si at den reagerer med vannet ved å frigjøre OH -grupper- som er de som gir alkalinitet til løsningene:
Co32- + H2Eller ⇔ Åh- + HCO3-
HCO3- + H2Eller ⇔ Åh- + H2Co3
Å skaffe
Kan fås fra den gjenværende asken når du brenner planter. Også ved karbonatisering av KOH kaliumhydroksyd, det vil si tilsetning av overflødig karbondioksid CO2 Til Koh:
KOH + CO2 → KHCO3
2 KHCO3 + varme → k2Co3 + H2ENTEN
En annen måte å skaffe det er å varme opp KCl -kaliumklorid med magnesiumkarbonat3, vann og co2 under press. Et dobbelt hydratisert magnesium og kaliumsalt og kalium oppnås først3.KHCO3.4H2Eller, kalt Engels Salt:
2 KCl + 3 Mgco3 + Co2 + 5 H2O → MGCO3.KHCO3.4H2Eller ↓ + mgcl2
Det doble hydratiserte saltet av Engels utfeller og skiller seg fra løsningen ved filtrering. Deretter blir kaliumbilkarbonatet oppvarmet og dannet2Co3 at ved å tilsette vann løses opp mens Mgco magnesiumkarbonat3 forblir uoppløselig og eliminert ved filtrering.
MGCO3.KHCO3.4H2O + varme → mgco3↓ + 2 k+ + Co32- + Co2↑ + 9 H2ENTEN
applikasjoner
I absorpsjonen av CO2 I industrielle prosesser
Kaliumkarbonatløsning er den klassiske behandlingen for fjerning av karbondioksid CO2 I forskjellige prosesser, spesielt i høyt trykk og temperaturapplikasjoner.
 K -løsninger2Co3 De er vant til å absorbere CO2 I forskjellige industrielle prosesser. Forfatter: Nicola Giordano. Kilde: Pixabay.
K -løsninger2Co3 De er vant til å absorbere CO2 I forskjellige industrielle prosesser. Forfatter: Nicola Giordano. Kilde: Pixabay. Fjerning av CO2 oppstår i henhold til følgende reaksjon:
K2Co3 + Co2 + H2Eller ⇔ 2 khco3
Denne metoden brukes for eksempel for å behandle naturgass. Også i energiproduksjonsanlegg, for å unngå utslipp av CO2 til atmosfæren, og i produksjonen av tørris.
Kan tjene deg: kobberhydroksid (ii): struktur, egenskaper, nomenklatur, bruk K -løsninger2Co3 De brukes til å få CO2 som tjener til å lage tørris. ProjectManHattan [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
K -løsninger2Co3 De brukes til å få CO2 som tjener til å lage tørris. ProjectManHattan [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. K -løsning2Co3 Det kan regenerere termisk, det vil si på grunn av temperaturer oppover rundt 100 ° C.
For at kaliumkarbonatoppløsning skal absorbere CO2 med god hastighet, blir promotorer lagt til som akselererer prosessen som Dietanolamine (DEA).
I fjerning av h2S av visse prosesser
Kaliumkarbonatløsninger brukes også til å fjerne hydrogensulfidgass H2S av prosessstrømmer. Noen ganger tilsettes kalium tiffosfat k3Po4 For å gjøre raskere prosessen.
I kjemilaboratorier
K2Co3 tillater organisk syntese, for eksempel i kondensasjonsreaksjoner og å nøytralisere. Det tjener til å fjerne vann fra organiske væsker, som et dehydrerings- eller tørkemiddel i laboratoriet.
Det brukes også i analytiske kjemiske reaksjoner og for å alkalisere i legemiddelindustrien.
I rengjøringsproduktindustrien
K2Co3 Den brukes til å produsere såpe, rengjøringsformler, produkter for klær og hvitvasking av retter og også for å tilberede sjampo og andre personlige pleieprodukter.
 K2Co3 Det brukes i såpeforberedelse. Lacrosus [Public Domain]. Kilde: Wikimedia Commons.
K2Co3 Det brukes i såpeforberedelse. Lacrosus [Public Domain]. Kilde: Wikimedia Commons. I matindustrien
Kaliumkarbonat tilsettes forskjellige matvarer med flere formål.
For eksempel blir det lagt til kakaofrø for å eliminere deres bitre smak og bruke dem i sjokoladeproduksjon. Det legges til druene i tørkeprosessen for å oppnå roside druer.
 Kakaofrø behandles med K2Co3 For å redusere den bitre smaken når du lager sjokolade. Forfatter: Magali Couret. Kilde: Pixabay.
Kakaofrø behandles med K2Co3 For å redusere den bitre smaken når du lager sjokolade. Forfatter: Magali Couret. Kilde: Pixabay. I konditorbutikk brukes det som en leudant (fungerer som en gjær) av melet for å tilberede bakt mat.
Kan tjene deg: lutecio: struktur, egenskaper, bruk, innhenting K2Co3 Det kan brukes som en ledant i kaker fordi når det gir fra CO2 Under matlagingen øker du volumet. Forfatter: Pixel1. Kilde: Pixabay.com
K2Co3 Det kan brukes som en ledant i kaker fordi når det gir fra CO2 Under matlagingen øker du volumet. Forfatter: Pixel1. Kilde: Pixabay.com I gjødsel
K2Co3 Det brukes til å gjødsle syre jordsmonn, som kullionen CO32- I kontakt med vann produserer OH -ioner- som øker pH på bakken. I tillegg til kalium k+ Det er et næringsstoff for planter.
Kaliumkarbonat har også blitt brukt til å gjøre sakte -frigjøringsgjødsel.
En langsom frigjøringsgjødsel frigjør eller løse næringsstoffer slik at de ikke blir oppløst og dratt av vann. Takket være dette kan de bruke mer tid tilgjengelig for plantøtter.
I flere applikasjoner
Kaliumkarbonat k2Co3 Det brukes også til:
- Tørking, blekede og rengjør rengjøringsprosesser og andre tekstilindustriaktiviteter
- Oppnå andre organiske og uorganiske kaliumsalter, for eksempel KCN kaliumcyanid.
- Funksjon som en surhetsregulator i forskjellige prosesser.
- Lage keramikk og keramikk.
- Graverings- og litografiprosesser.
- Solbrun.
- Forbered utskriftsblekk, pigmenter.
- Manufacce glass2Co3 Det er mer kompatibelt enn for natriumkarbonat NA2Co3 Med bly-, barium- og strontiumoksider som disse glassene inneholder.
- Vannbehandling.
- Forsink brann (i form av vandige oppløsninger).
- Hemmer korrosjon og som et antisparingsmiddel i prosessteam.
Referanser
- ELLER.S. National Library of Medicine. (2019). Kaliumkarbonat. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Steele, d. (1966). Kjemien til de metalliske elementene. Pergamon Press Ltd. London.
- Mokhatab, s. et al. (2019). Naturgassbehandling. Kaliumkarbonatløsningen. I Handbook of Natural Gas Transmission and Processing (fjerde utgave). Gjenopprettet fra Scientedirect.com.
- Kakaras, e. et al. (2012). Trykk på fluidisert bed forbrenning (PFBC) kombinert syklussystemer. Fullet forbrenning av fluidisert seng med karbonfangst og lagring. I kombinerte syklussystemer for nesten null utslippskraftproduksjon. Gjenopprettet fra Scientedirect.com.
- Speight, J.G. (2019). Hydrogenproduksjon. Våt skrubbe. I kraftig oljeutvinning og oppgradering. Gjenopprettet fra Scientedirect.com.
- Branan, ca.R. (2005). Gassbehandling: Kapittel Oppdatert av Chris Higman. Hot karbonatprosess. I tommelfingerregler for kjemiske ingeniører (fjerde utgave). Gjenopprettet fra Scientedirect.com.
- Kirk-Ohmer (1994). Encyclopedia of Chemical Technology. Fjerde utgave. John Wiley & Sons.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte utgave. VCH Verlagsgellschaft MBH.
- Li, og. og Cheng, f. (2016). Syntese av en ny langvarig kaliumgjødsel fra modifisert Pidgeon magnesium slagg ved kaliumkarbonat. J Air Waste Management Assoc, 2016 Aug; 66 (8): 758-67. NCBI kom seg.NLM.NIH.Gov.

