Sinkkarbonat (ZnCO3) struktur, egenskaper, bruk

- 3514
- 55
- Jonathan Carlsen
Han sinkkarbonat Det er en uorganisk forbindelse dannet av sink (Zn), karbon (C) og oksygen (O) elementer (O). Den kjemiske formelen er ZNCO3. Sink har en oksidasjonstilstand på +2, karbon +4 og oksygen -2.
Det er et fargeløst eller hvitt fast stoff som finnes i naturen som danner Smithsonite -mineralet, der det kan være alene eller med andre elementer som henholdsvis kobolt eller kobber, som gir det henholdsvis en fiolett eller grønn farge.
 Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. ZNCO3 Det er nesten uoppløselig i vann, men det blir lett oppløst i fortynnede syrer, ettersom karbonationet i sur karbononisk form (H2Co3), som da blir CO -gassen2 og vann.
Det brukes som et antiseptisk middel i dyresår og tilføres noen ganger i kostholdet for å unngå sykdommer forårsaket av sinkmangel.
Det tjener til å utsette det brente at visse fibre, plast og tannkjøtt når de kommer i kontakt med brann. Gjør det mulig å skille giftige arsen mineraler fra andre bergarter trygt.
Det har blitt brukt i dentifriske pastaer for å gjenopprette dentin i tennene under bleking.
[TOC]
Struktur
ZNCO3 Det dannes av en Zn -kation2+ og en anion co32-. Karbon i karbonationet har en oksidasjonstilstand på +4. Dette ionet har en flat struktur med de tre oksygenatomene som omgir karbonatom.
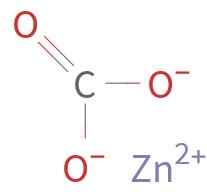 Kjemisk struktur av sinkkarbonat. Ukjent forfatter / offentlig domene. Kilde: Wikimedia Commons.
Kjemisk struktur av sinkkarbonat. Ukjent forfatter / offentlig domene. Kilde: Wikimedia Commons. Nomenklatur
- Sinkkarbonat
- Sinkmonokarbonat
- Kullsyre sinksalt
- Smithsonita
- Sink spyttet
Egenskaper
Fysisk tilstand
Fargeløs fast eller krystallinsk hvit. Rombiske krystaller.
 Sinkkarbonat. Ondřej Mangl / Pub Domain. Kilde: Wikimedia Commons.
Sinkkarbonat. Ondřej Mangl / Pub Domain. Kilde: Wikimedia Commons. Molekylær vekt
125,4 g/mol
Smeltepunkt
Ved 140 ºC bryter det sammen uten smelting.
Tetthet
4.398 g/cm3 ved 20 ° C.
Løselighet
Praktisk talt uoppløselig i vann: 0,000091 g/100 g h2Eller ved 20 ° C. Oppløselig i fortynnede syrer, alkalier og ammoniumsalter. Uoppløselig i ammoniakk, alkohol og aceton.
Kjemiske egenskaper
Reagerer med syrer som danner karbondioksid:
Znco3 + 2 h+ → Zn2+ + H2Eller + co2↑
Den løses opp i baser som danner hydroksyd, som delvis oppløses og danner et ion av sinkato:
Kan tjene deg: Bromin: Historie, struktur, elektronisk konfigurasjon, egenskaper, bruksområderZnco3 + 2 Å- → Zn (OH)2 + Co32-
Zn (OH)2 + H2Eller + åh- → [Zn (OH)3(H2ENTEN)]-
Det er ikke brannfarlig. Når den er oppvarmet til nedbrytningen, produserer sinkoksid og karbondioksid, men kan avgi karbonmonoksid (CO).
Znco3 + Varme → ZnO + CO2↑
Å skaffe
Smithsonite -mineralet er oppnådd, tidligere kalt Zinc's Spett.
Det kan også tilberedes ved å blande en natriumkarbonatoppløsning med sinksalt, for eksempel sinksulfat. Natriumsulfat forblir oppløst og sinkkarbonat presipitater:
Znso4 + Na2Co3 → ZNCO3↓ + Na2SW4
applikasjoner
I medisinske behandlinger
Denne forbindelsen lar deg skaffe noen farmasøytiske produkter. Det påføres den betente huden i form av støv eller lotion.
I veterinærapplikasjoner
ZNCO3 Det fungerer som en snerpende, antiseptisk og aktuell beskytter av dyr hos dyr.
Det tillater også å forhindre sykdommer forårsaket av sinkmangel, så det brukes som et supplement i kostholdet til noen dyr, forutsatt at de administrerte mengdene er innenfor normene som helset er etablert av helsebyråer.
 Sinkkarbonat administreres noen ganger som et mikronæringsstoff for å unngå sykdommer hos griser. Ukjent forfatter / CC0. Kilde: Wikimedia Commons.
Sinkkarbonat administreres noen ganger som et mikronæringsstoff for å unngå sykdommer hos griser. Ukjent forfatter / CC0. Kilde: Wikimedia Commons. I porcheratosisutbrudd hos griser blir det lagt til kostholdet til disse. Denne sykdommen er en endring av huden der hornhinnelaget ikke er riktig dannet.
Som flammehemmende
Det brukes som brannsikker fylling for gummi og plast som er utsatt for høye temperaturer. Lar deg beskytte tekstilfibre mot brann.
Når det gjelder bomullstekstiler, brukes det på stoffet sammen med noen alkali. Dette angriper direkte primære hydroksylgrupper (-CH2Å) av cellulose og gjør dem sodiocellulose (-CH2PÅ EN).
Rupturen av cellulosekoblinger av alkalien favoriserer større gjennomtrengbarhet av kjedene i den kompakte cellulosstrukturen, slik at mer ZNCO -mengde3 klarer å gå inn i den amorfe sonen for dette, og spredningen er tilrettelagt.
Kan tjene deg: vanadium: historie, egenskaper, struktur, bruk Noen bomullsstoffer kan inneholde ZNCO3 i fibrene deres for å gjøre dem motstandsdyktige mot brann. Socken_farbig.JPEG: Scott Bauererivative Work: Sock / Public Domain. Kilde: Wikimedia Commons.
Noen bomullsstoffer kan inneholde ZNCO3 i fibrene deres for å gjøre dem motstandsdyktige mot brann. Socken_farbig.JPEG: Scott Bauererivative Work: Sock / Public Domain. Kilde: Wikimedia Commons. Som et resultat av dette reduseres mengden av brennbar gass som kan oppstå med brann.
I tannbehandlinger
Enkelte dentifriske kremer basert på sinkkarbonatnanokrystaller og hydroksyapatitt påført regelmessig på protese reduserer overfølsomhet mer effektivt enn de som er basert på fluor.
Nanokrystallene til Znco3 og hydroxiapatitt har en størrelse, form, kjemisk sammensetning og krystallinitet som ligner på dentinet, slik at tannrørene kan lukkes med påføring av disse materialene.
 Znco nanopartikler3-Hydroksiapatitt er blitt testet med hell for å redusere følsomheten i blekede tenner. Forfatter: fotomiks. Kilde: Pixabay.
Znco nanopartikler3-Hydroksiapatitt er blitt testet med hell for å redusere følsomheten i blekede tenner. Forfatter: fotomiks. Kilde: Pixabay. Denne typen tannpastaer var nyttige etter tannblekingsprosesser.
Å skille farlige arsen mineraler
Arsen mineralmetoder for svovelbergarter (som galena, chalcopyrite og pyritt) er testet ved bruk av ZNCO)3. Malmen i arsen må skilles fra andre fordi dette elementet er en veldig giftig og giftig forurensende for levende vesener.
For å oppnå dette behandles blandingen av malte bergarter med en sinksulfatoppløsning og natriumkarbonat til en pH på 7,5-9,0 og en xantatforbindelse.
 Arsenopirita. Dette mineralet skal skilles fra andre fordi det inneholder arsen giftig. Separasjon kan oppnås med sinkkarbonat. James St. John/CC av (https: // creativecommons.Org/lisenser/av/2.0). Kilde: Wikimedia Commons.
Arsenopirita. Dette mineralet skal skilles fra andre fordi det inneholder arsen giftig. Separasjon kan oppnås med sinkkarbonat. James St. John/CC av (https: // creativecommons.Org/lisenser/av/2.0). Kilde: Wikimedia Commons. Effektiviteten av formelen tilskrives dannelsen av små ZNCO -partikler3 På overflaten av arsenopyritten gjør den hydrofil (relatert til vann), slik at du ikke kan følge luftbobler og ikke kan flyte, utfelle og skille seg fra de andre mineralene.
Ved å få andre sinkforbindelser
Sinkkarbonat har blitt brukt for å oppnå hydrofobe nanostrukturer av borat av formel 3zno • 3b2ENTEN3• 3.5H2ENTEN. Dette materialet kan brukes som et flammehemmende tilsetningsstoff i polymerer, tre og tekstiler.
I utvinningen av sink av gjenværende avløpsvann
Rike syntetiske farvann på sinkioner kastet av elektroavsetningsprosesser kan behandles ved fluidisert sengeteknologi ved bruk av natriumkarbonat for å utfelle ZNCO3.
Kan tjene deg: sekundær alkohol: hva er, struktur, egenskaper, brukNår Zn presipiterer2+ I form av karbonat reduserer dens konsentrasjon, blir det oppnådde faste stoff filtrert og vannet kan kastes trygt. ZNCO3 bunnfall er høy renhet.
Andre apper
Tillater å tilberede andre sinkforbindelser. Det brukes i kosmetikk. Det fungerer som et pigment og brukes til fremstilling av porselen, keramikk og keramikk.
Risiko
ZNCO støvinnånding3 Det kan forårsake kjennelse, hoste, bryst, feber og svette ubehag. Sovestrekken gir kvalme og oppkast.
Effekter på miljøet
Hovedrisikoen er effekten av miljøet, så den bør unngås å være spredt i dette. Det er veldig giftig for vannlevende liv med konsekvenser som varer i levende organismer.
Referanser
- ELLER.S. National Library of Medicine. (2019). Sinkkarbonat. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Sharma, v. et al. (2018). Syntese av sinkkarbonat nanoneedles, til potensiell flammehemmende for bomullstekstiler. Cellulose 25, 6191-6205 (2018). Lenke gjenopprettet.Springer.com.
- Guan, og. et al. (2020). Kolloidal ZnCO3 som en kraftig deprimerende av arsenopyritt i svakt alkalisk masse og interaksjonsmekanismen. Mineraler 2020, 10, 315. MDPI kom seg.com.
- Sykdommer i huden, øyet, konjunktiva og ytre øre. (2017). I veterinærmedisin (ellevte utgave). Gjenopprettet fra Scientedirect.com.
- Hannig, m. og Hannig, C. (2013). Nanobiomaterialer i forebyggende tannbehandling. I nanobiomaterialer i klinisk tannbehandling. Kapittel 8. Gjenopprettet fra Scientedirect.com.
- Tugrul, n. et al. (2015). Syntese av hydrofobe nanostrukturer sink borrer fra sinkkarbonat og karakterisering av produktet. Res Chem Intermediate (2015) 41: 4395-4403. Lenke gjenopprettet.Springer.com.
- Luna, m.D.G., et al. (2020). Gjenvinning av sinkgranulater fra syntetisk elektroplatering av avløpsvann ved bruk av fluidisert-ked homogen krystalliseringsprosess. Int. J. Miljø. Sci. TECHNOL. 17, 129-142 (2020). Lenke gjenopprettet.Springer.com.
- « Bestemte og universelle proposisjonsegenskaper
- Hva er den økonomiske prosessen? Stadier og eksempler »

