Karbon

- 3480
- 439
- Magnus Sander Berntsen
Hva er karbon?
Han karbon Det er et ikke -metallisk kjemisk element hvis kjemiske symbol er c. Navnet skyldes kull, grønnsaker eller mineral, der atomene definerer forskjellige strukturer. Det danner et bredt spekter av organiske og uorganiske forbindelser, og presenterer seg også i et betydelig antall alotroper.
Karbon finnes i alle levende vesener; Alle dens biomolekyler skylder sin eksistens til stabiliteten og styrken til C-C-bindingene og deres høye tendens til sammenkobling. Det er livets element, og med atomene deres er kroppene deres bygget.
De organiske forbindelsene som biomaterialer er bygget med, består av kullsyreholdige og heteroatomer skjeletter. Disse kan sees ved første øyekast i trenes tre; Og også når lynet faller på dem og rostiza. Det gjenværende inerte svart fast stoff har også karbon; Men det er et grønnsakskull.
Karbonegenskaper
De fysiske eller kjemiske egenskapene som finnes i faste stoffer, mineraler eller karbonholdige materialer er utsatt for mange variabler. Blant dem er: sammensetningen eller grad av urenheter, hybridasjonene av karbonatomer, mangfoldet av strukturer og porens morfologi eller størrelse.
Når egenskapene til karbon beskriver, er flertallet av bibliografiske tekster eller kilder basert på grafitt og diamant.
Fordi? Fordi de er de mest kjente alotropene for dette elementet og representerer faste stoffer eller materialer med høy renhet; Det vil si at de praktisk talt ikke har gjort noe mer enn karbonatomer (selv om de med forskjellige strukturer vil bli forklart i følgende avsnitt).
Egenskapene til vegetabilsk og mineralkull er forskjellige i henholdsvis deres opprinnelse eller sammensetninger. For eksempel lignitt (dårlig karbon) som et gatea -drivstoff sammenlignet med antracitt (karbonrik). Og hva du skal si om de andre alotropene: nanorør, fullerenos, grafen, grafikk, etc.
Imidlertid har de kjemisk et felles punkt: de oksiderer med et overskudd av oksygen i CO2:
C + ENTEN2 => Co2
Nå er hastigheten eller temperaturen de trenger for å oksidere egen for hver av disse alotropene.
Grafitt vs diamant
Her vil det også bli gitt en kort kommentar angående de forskjellige egenskapene for disse to alotropene:
 Tabell der noen egenskaper til de to krystallinske alotrops karbon sammenlignes. Kilde: Gabriel Bolívar.
Tabell der noen egenskaper til de to krystallinske alotrops karbon sammenlignes. Kilde: Gabriel Bolívar. Elektronisk struktur og konfigurasjon
Hybridasjoner
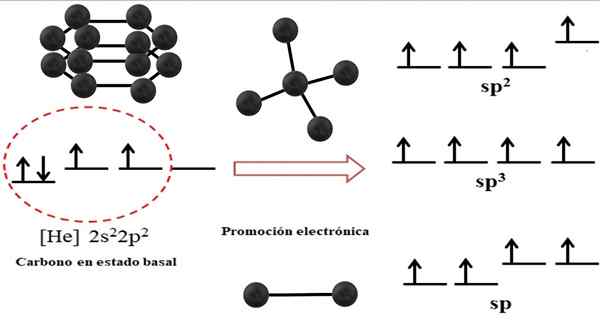 Forholdet mellom hybrid orbitaler og mulige strukturer for karbon. Kilde: Gabriel Bolívar.
Forholdet mellom hybrid orbitaler og mulige strukturer for karbon. Kilde: Gabriel Bolívar. Den elektroniske konfigurasjonen for karbonatom er 1s22s22 s2, også skrevet som [han] 2s22 s2 (Øvre bilde). Denne representasjonen tilsvarer dens basalstatus: karbonatomet isolert og suspendert i et slikt vakuum som ikke kan samhandle med andre.
Kan tjene deg: krystallinsk strukturDet blir satt pris på at en av 2p -orbitaler mangler elektroner, som aksepterer et elektron av den mindre energitroppen ved elektronisk promotering; Og dermed får atomet muligheten til å danne opptil fire kovalente bindinger gjennom sine fire SP -hybrid -orbitaler3.
Merk at de fire orbitalene sp3 De er degenerert i energi (justert på samme nivå). Orbitalene p Ren er mer energiske, og det er grunnen til at de er over de andre hybrid -orbitalene (til høyre for bildet).
Hvis det er tre hybride orbitaler, er det fordi en orbital gjenstår p uten hybridisering; Derfor er de tre SP -orbitaler2. Og når det er to av disse hybridbanene, to orbitaler p De er tilgjengelige for å danne doble eller trippelbindinger, og er hybridiseringen av F -karbonet.
Slike elektroniske aspekter er viktige for å forstå hvorfor karbon kan finnes i alotropes uendelig.
Oksidasjonstall
Før du fortsetter med strukturene, er det ikke andre å nevne at gitt den elektroniske konfigurasjonen av Valencia 2s22 s2, Karbon kan ha følgende oksidasjonstall: +4, +2, 0, -2 og -4.
Fordi? Disse tallene tilsvarer antakelsen om at det er en ionisk binding slik at du danner ionene med de respektive belastningene; det vil si C4+, C2+, C0 (nøytral), C2- og c4-.
For at karbon skal ha et positivt oksidasjonsnummer, må det miste elektronene; Og for å gjøre det, må det nødvendigvis kobles til veldig elektronegative atomer (for eksempel oksygen).
I mellomtiden, for at karbon skal ha et negativt oksidasjonsnummer, må det få elektroner som kobler til metall eller mindre elektronegative atomer enn ham (for eksempel hydrogen).
Det første oksidasjonsproblemet, +4, betyr at karbon har mistet alle valenselektroner; Orbitalene 2s og 2p er tomme. Hvis 2p -orbitalen mister sine to elektroner, vil karbonet ha +2 oksidasjonsnummer; Hvis du vinner to elektroner, vil du ha -2; Og hvis han vinner to elektroner som mer fullfører oktetten sin fra Valencia, -4.
Eksempler
For eksempel for CO2 Karbonoksidasjonsnummeret er +4 (fordi oksygen er mer elektronegativ); Mens for Cho4, er -4 (fordi hydrogen er mindre elektronegativ).
Kan tjene deg: hydrazin: struktur, egenskaper, syntese, brukFor Ch3Å, karbonoksidasjonsnummeret er -2 (+1 for H og -2 for O); Mens for HCOOH er det +2 (sjekk at summen av 0).
Andre oksidasjonstilstander, for eksempel -3 og +3, er også sannsynlige, spesielt når det gjelder organiske molekyler; For eksempel i metylgrupper, -CH3.
Molekylære geometrier
I det overordnede bildet ble ikke bare hybridiseringen av orbitalene for karbonatomet vist, men også de resulterende molekylære geometrier når flere atomer (svarte kuler) er knyttet til en sentral. Dette sentrale atomet for å avhende et spesifikt geometrisk miljø i rommet, må ha den respektive kjemiske hybridiseringen som er tillatt.
For eksempel, for tetrahedronen, har det sentrale karbonet SP -hybridisering3; Fordi slik er det mest stabile arrangementet for Four Hybrid SP3. I tilfelle av SP -karbonatomer2, De kan danne doble lenker og avhende et trigonalt flatt miljø; Og så definerer disse trekantene en perfekt sekskant. Og for en SP -hybridisering tar karbonatomer lineær geometri.
Dermed styres geometrier som er observert i strukturene til alle alotroper ganske enkelt i Tetrahedra (SP3), sekskanter eller pentagoner (SP2), og linjer (SP).
Tetrahedra definerer en 3D -struktur, mens sekskanter, pentagoner og linjer, 3D- eller 2D -strukturer; Sistnevnte kommer til å være flyene eller arkene som ligner på veggene i Bee Honeycombs:
 Vegg med sekskantede design av en biehoneycomb i analogi med planene sammensatt av SP2 -karbonatomer. Kilde: Pixabay.
Vegg med sekskantede design av en biehoneycomb i analogi med planene sammensatt av SP2 -karbonatomer. Kilde: Pixabay. Og hvis vi bretter denne sekskantede veggen (femkantet eller blandet), vil vi få et rør (nanorør) eller en ball (fulleren), eller en annen figur. Interaksjonene mellom disse tallene gir anledning til forskjellige morfologier.
Amorfe eller krystallinske faste stoffer
Etterlater geometrier, hybridiseringer eller morfologier av mulige karbonstrukturer, kan deres faste stoffer klassifisere globalt i to typer: amorf eller krystallinsk. Og mellom disse to klassifiseringene er deres alotropes distribuert.
Amorf karbon er ganske enkelt den som presenterer en vilkårlig blanding av tetrahedra, sekskanter eller linjer, som ikke er i stand til å etablere et strukturelt mønster; Slik er tilfellet med kull, grønnsaker eller aktivert kull, koks, sot, etc.
Mens krystallinsk karbon består av strukturelle mønstre dannet av noen av geometriene som er hevet; For eksempel diamant (tre -dimensjonalt tetrahedra nettverk) og grafitt (stablede sekskantede ark).
Kan tjene deg: natriumnitrat (nano3): struktur, egenskaper, bruksområder, risikoHvor er karbon?
I tillegg til å være det kjemiske elementet som er vanlig i alle former for liv, er karbon i naturen til stede i tre krystallinske former: diamant, grafitt og guide.
Det er også flere amorfe kullmineralformer (antracitt, lignitt, stum, torv), flytende former (varianter av petroleum) og brus (naturgass).
applikasjoner
Igjen, som egenskapene og strukturen, er bruksområder eller applikasjoner i samsvar med alotrogoer eller mineralogiske former for karbon. Imidlertid er det visse generaliteter som kan nevnes, i tillegg til noen veldig kjente punkter. Slike er:
-Karbon har blitt brukt i lang tid som et mineralreduserende middel for å oppnå rene metaller; For eksempel jern, silisium og fosfor, blant andre.
-Det er hjørnesteinen i livet, og organisk kjemi og biokjemi er studiene av denne refleksjonen.
-Det har også vært et fossilt drivstoff som gjorde at de første maskinene går til girene. På samme måte ble karbongass for gamle lyssystemer oppnådd fra ham. Kull var synonymt med lys, varme og energi.
-Blandet som tilsetningsstoff med jern i forskjellige proporsjoner tillot oppfinnelse og forbedring av stål.
-Den svarte fargen fant sted i kunst, spesielt grafitt og alle skrifter laget med sine slag.
Risiko og forholdsregler
Karbon og dets faste stoffer representerer ingen helserisiko. Som har bekymret seg for en kullpose? De selger dem til mye i hallene i noen markeder, og så lenge det ikke er nær brann, vil ikke de svarte blokkene deres brenne.
Koksen derimot kan representere en risiko hvis svovelinnholdet er høyt. Når forbrenning vil frigjøre svovelgasser som, i tillegg til å være giftig, bidrar til surt regn. Og selv om CO2 I små mengder kan det ikke kveles oss, det gjør en enorm innvirkning på miljøet som en klimagass.
Fra dette perspektivet er karbon en "langvarig" fare, siden forbrenningen endrer klimaet på planeten vår.
Og i en mer fysisk forstand, blir faste stoffer eller karbonholdige materialer hvis de blir sprayet lett transportert med luftstrømmer; Og følgelig blir de introdusert direkte til lungene, noe som uforsvarlig kan skade dem.
Av resten er det veldig vanlig å konsumere "kull" når litt mat lager mat.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.

