Treningskation, forskjeller med anion og eksempler
- 3252
- 965
- Thomas Karlsen
EN kation Det er en kjemisk art som har en positiv ladning. De to typene eksisterende ioner er for anionen. Belastningen er produktet av en elektronmangel i atomet, som får kjerneprotonene til å utøve en større attraksjon. For hvert elektron som mister et nøytralt atom, økes den positive belastningen i en enhet.
Hvis et atom mister et elektron, og derfor er antall protoner større enn ett, vil den positive belastningen være +1; Hvis du mister to elektroner, vil belastningen være +2, og så videre. Når en kation har en +1 belastning, sies det å være monovalent; På den annen side, hvis nevnte belastning er større enn +1, sies det at kationen er allsidig.
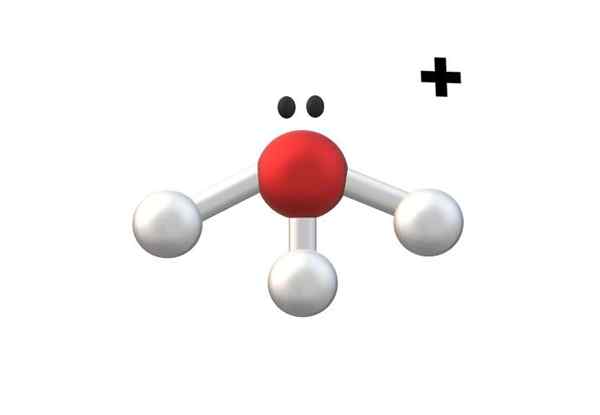
 Hydronio ion, en av de enkleste kationene kationer. Kilde: Gabriel Bolívar.
Hydronio ion, en av de enkleste kationene kationer. Kilde: Gabriel Bolívar. I det øvre bildet er det vist til kation h3ENTEN+, kalt hydronio ion. Som det kan sees, har den knapt en +1 belastning, i samsvar med en monovalent kation.
Kationer er viktige arter, siden de utøver en elektrostatisk kraft med miljøet og molekylene rundt. De har et høyt samspill med vann, væske som hydrerer og transporterer dem i våt jord, og når deretter røttene til plantene og brukes til deres fysiologiske funksjoner.
[TOC]
Hvordan dannes en kation?
Det ble nevnt at når et atom mister et elektron, utøver det største antallet protoner, i forhold til elektroner, en attraksjonskraft som oversettes til en positiv belastning. Men hvordan kan elektrontap oppstå? Svaret avhenger av transformasjonen som skjedde i kjemiske reaksjoner.
Det skal bemerkes at tilstedeværelsen av et atom med positiv belastning ikke nødvendigvis innebærer dannelse av en kation. Slik at det kan betraktes som sådan, skal det ikke være et atom med en negativ formell belastning som nøytraliserer. Ellers ville det være tiltrekning og frastøtning innenfor samme forbindelse og ville være nøytral.
Kan tjene deg: kalsiumsulfat (case4): kjemisk struktur, egenskaper, brukFormelle kostnader og flere lenker
Elektronegative atomer tiltrekker elektronene til sine kovalente bindinger mot dem. Selv om elektroner deles likt, er det et punkt hvor de delvis vil ha mindre elektroner enn i sin basalkonfigurasjon; Dette er, for deres frie atomer uten å være knyttet til andre elementer.
Deretter vil disse elektronegative atomer begynne å oppleve en elektronmangel, og med den vil protonene til kjernene deres utøve en kraft med større tiltrekning; Den positive formelle belastningen blir født. Hvis det bare er en positiv formell belastning, vil forbindelsen manifestere en global positiv ionisk belastning; Dermed ble kationen født.
Oksygenatomet i kation h3ENTEN+ Det er et trofast eksempel på ovennevnte. Ved å ha tre O-H-bindinger, en mer enn i vannmolekylet (H-O-H), opplever tapet av et elektron med hensyn til basaltilstand. Beregningene av de formelle belastningene gjør det mulig å bestemme når dette skjer.
Hvis dannelsen av en annen O-H antas for et øyeblikk, vil den divalente kationen oppnås4ENTEN2+. Merk at den divalente belastningen på toppen av kationen er skrevet som følger: antall fulgte '+' -symbolet; På samme måte fortsatte anionene.
Oksidasjon
Metaller er kationformatorer par excellence. Imidlertid kan ikke alle danne kovalente bindinger (eller i det minste rent kovalent). I stedet mister de elektroner for å etablere ioniske bindinger: en positiv belastning tiltrekker seg en negativ, forent av fysiske krefter.
Derfor mister metaller elektroner for å bevege seg fra m til mn+, hvor n Det er vanligvis lik antallet av gruppen din i det periodiske tabellen; selv om n Du kan ta flere hele verdier, som skjer spesielt med overgangsmetaller. Dette tapet av elektroner utføres i en type kjemisk reaksjon som kalles oksidasjon.
Kan tjene deg: Tertiær alkohol: struktur, egenskaper, eksemplerMetallene oksiderer, mister et elektron, antall protoner av atomene deres overstiger elektronene, og viser følgelig en positiv belastning. For at det skal være oksidasjon, må det være et oksidasjonsmiddel, noe som reduserer eller får elektroner tapt av metaller. Oksygen er det mest kjente oksidasjonsmiddel av alle.
Forskjeller med anion
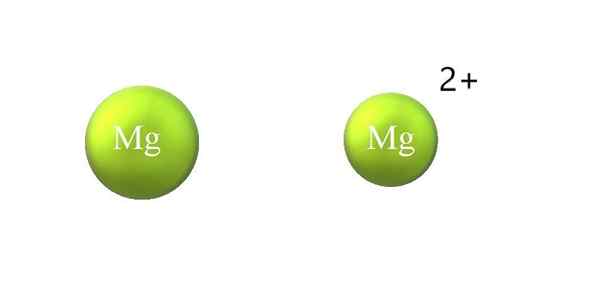 Atomisk radius sammentrekning i en kation. Kilde: Gabriel Bolívar.
Atomisk radius sammentrekning i en kation. Kilde: Gabriel Bolívar. Nedenfor er forskjellene mellom en kation og anion:
-Den generelle kationen er mindre enn anion. Det øvre bildet viser hvordan atomradiusen til Mg reduseres ved å miste to elektroner og bli Mg -kationen2+; Det motsatte skjer med anioner: de blir mer klumpete.
-Den har flere protoner enn elektroner, mens anion har flere elektroner enn protoner.
-Å være mindre, dens belastningstetthet er høyere, og har derfor større polariserende kraft; det vil si deformerer de elektroniske skyene til naboatomer.
-En kation beveger seg i samme retning som for det påførte elektriske feltet, mens anionen gjør det i motsatt retning.
Eksempler på de vanligste kationene
Monoatomic
Monoatomiske kationer kommer stort sett fra metaller (bortsett fra visse unntak, for eksempel H+). Av resten er det ekstremt sjelden å vurdere en kation avledet fra et ikke -metallisk element.
Det vil sees at mange av dem er DI eller allsidige, og at størrelsene på belastningene deres stemmer overens med antallet grupper i det periodiske bordet.
Det kan tjene deg: ribulosa-1,5-bifosfat (RUBP): Karakteristikker, karbolixering-Li+
-Na+
-K+
-RB+
-CS+
-Fr+
-AG+
Alle har til felles belastningen '1+', som er skrevet uten å plassere nummeret, og kommer også fra gruppe 1: Alkalinmetaller. Dessuten er det kation AG+, En av de vanligste overgangsmetaller.
-Være2+
-Mg2+
-Ac2+
-MR2+
-Ba2+
-Ra2+
Disse divalente kationene stammer fra sine respektive metaller som tilhører gruppe 2: Alkalinerior metaller.
-Til3+
-Ga3+
-I3+
-Tl3+
-NH3+
Trivalente kationer av Boro -gruppen.
Så langt har eksemplene blitt karakterisert ved å ha en enkelt valens eller belastning. Andre kationer viser mer enn en valens eller positiv oksidasjonstilstand:
-Sn2+
-Sn4+ (tinn)
-Co2+
-Co3+ (kobolt)
-Au+
-Au3+ (gull)
-Tro2+
-Tro3+ (jern)
Og andre metaller, for eksempel mangan, kan fortsatt ha mange flere valenser:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Jo større belastning, mindre og polarisering vil være kationen.
Polyiatomisk
Uten å gå inn i organisk kjemi, er det uorganiske og polylamiske kationer som er veldig vanlige i dagliglivet; som for eksempel:
-H3ENTEN+ (Hydronio, allerede nevnt).
-NH4+ (Ammonium).
-NEI2+ (Nitronio, til stede i nitreringsprosesser).
-Ph4+ (Fosfonium).
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (5. mai 2019). Definisjon og eksempel kation. Gjenopprettet fra: Thoughtco.com
- Wyman Elizabeth. (2019). Kation: Definisjon og eksempel. Studere. Gjenopprettet fra: Studie.com
- Dumminger. (2019). Positive og negative ins: kationer og anioner. Gjenopprettet fra: dummies.com
- Wikipedia. (2019). Kation. Gjenopprettet fra: er.Wikipedia.org
- « Anisolstruktur, egenskaper, nomenklatur, risiko og bruk
- Arkeolitisk opprinnelse, egenskaper, klima, flora og fauna »

