Cyclohexen -struktur, egenskaper, syntese og bruk

- 4114
- 146
- Oliver Christiansen
Han Cyclohexen Det er en alken eller syklisk olefin hvis molekylære formel er C6H10. Den består av en fargeløs væske, uoppløselig i vann og blandbar med mange organiske løsningsmidler. Det er preget av å være brennbar, og i naturen finnes det vanligvis i Hulla Tar.
Cyclohexen syntetiseres ved delvis hydrogenering av benzen og ved dehydrering av cykloheksanolalkohol; det vil si en mer oksidert måte. Som andre sykloalquenes, opplever det elektrofil tilsetning og frie radikaler; For eksempel halogeneringsreaksjon.
 Cyclohexen -molekyl. Kilde: Neurotoger.
Cyclohexen -molekyl. Kilde: Neurotoger. Dette sykliske (øvre bilde) danner aceotropiske blandinger (ikke separeres ved destillasjon), med lavere alkoholer og eddiksyre. Det er ikke veldig stabilt i langvarig lagring, siden den dekomponerer under handling av sollys og ultrafiolett stråling.
Cyclohexen brukes som et løsningsmiddel, og derfor har den mange applikasjoner, for eksempel: høy oktan bensinstabilisator og oljeekstraksjon.
Men det viktigste er at sykloheksenet fungerer som en mellomliggende og råstoff for å oppnå mange forbindelser med stor nytte, inkludert: cykloheksanon, adipinsyre, maleinsyre, sykloheksan, butyne, cykloheksylkarboksylsyre, etc.
[TOC]
Cyclohexen Structure
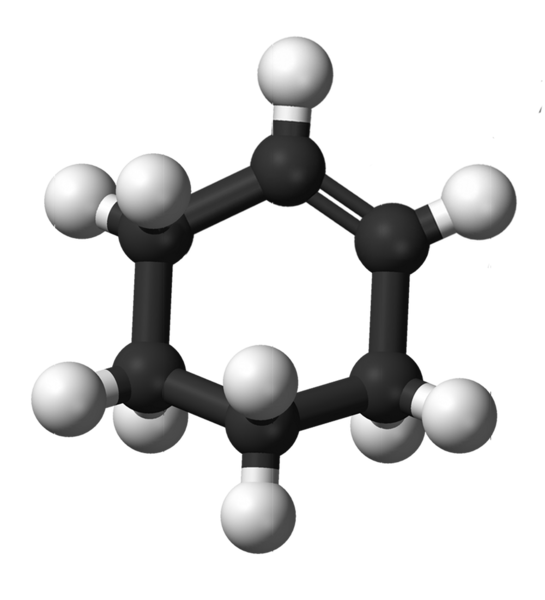 Cyclohexen Structure. Kilde: Kemikungen [Public Domain]
Cyclohexen Structure. Kilde: Kemikungen [Public Domain] Det øvre bildet viser strukturen til cyclohexen med en modell av kuler og søyler. Du kan legge merke til seks -karbonringen og dobbeltbindingen, både umettet av forbindelsen. Fra dette perspektivet ser det ut til at ringen er flat; Men det er ikke i det hele tatt.
For å starte har dobbeltbindingskarboner SP -hybridisering2, som gir dem en flat trigonal geometri. Derfor finnes disse to karbonatomer, og de ved siden av dem i samme plan; Mens de to karbonatomer i motsatt ende (til dobbeltbindingen), er over og under nevnte fly.
Kan tjene deg: spesifikk tyngdekraftDet underordnede bildet illustrerer perfekt det nylig forklarte.
 Front View of the Cyclohexen Structure. Kilde: Ben Mills.
Front View of the Cyclohexen Structure. Kilde: Ben Mills. Merk at den svarte stripen er sammensatt av fire karbonatomer: de to av dobbeltbindingen, og de andre ved siden av dem. Det utsatte perspektivet er det som ville bli oppnådd hvis en tilskuer plasserte øyet rett foran dobbeltlenken. Det kan da sees at et karbon er oppe og under dette planet.
Siden cyclohexen -molekylet ikke er statisk, vil de to karbonatomer bli byttet ut: Den ene vil gå ned mens den andre vil stige over flyet. Så det kan forventes å oppføre dette molekylet.
Intermolekylære interaksjoner
Cyclohexen er et hydrokarbon, og derfor er dets intermolekylære interaksjoner basert på spredningskrefter i London.
Dette er fordi molekylet er apolar, uten permanent dipol, og molekylvekten er den faktoren som mest bidrar til å holde den sammenhengende i væsken.
På samme måte øker dobbeltbindingen graden av interaksjon, siden den ikke kan bevege seg med samme fleksibilitet som for de andre karbonatområdene, og dette favoriserer samspillet mellom nabo molekyler. Det er av denne grunn at sykloheksenet har et litt større kokepunkt (83 ºC) enn Cyclohexane (81 ºC).
Egenskaper
Kjemiske navn
Cyclohexen, tetrahydribenzen.
Molekylær vekt
82,146 g/mol.
Fysisk utseende
Fargeløs væske.
Lukt
Søt lukt.
Kokepunkt
83 ºC til 760 mmhg.
Smeltepunkt
-103,5 ºC.
tenningspunkt
-7 ºC (lukket kopp).
Vannløselighet
Praktisk talt uoppløselig (213 mg/l).
Løselighet i organiske løsningsmidler
Blandbar med etanol, benzen, karbontetraklorid, oljeeter og aceton. Det forventes å kunne oppløse apolare forbindelser, for eksempel noen av kullalotropene.
Det kan tjene deg: Torio: struktur, egenskaper, innhenting, brukTetthet
0,810 g/cm3 ved 20 ºC.
Damptetthet
2,8 (med luftforhold tatt som lik 1).
Damptrykk
89 mmHg ved 25 ºC.
Selvretning
244 ºC.
Nedbrytning
Den dekomponerer i nærvær av uransalter, under sollys og ultrafiolett stråling.
Goo
0,625 mpascal ved 25 ° C.
Forbrenningsvarme
3.751,7 kJ/mol ved 25 ºC.
Fordampningsvarme
30,46 kJ/mol ved 25 ºC.
Overflatespenning
26,26 mn/m.
Polymerisasjon
Kan polymerisere under visse forhold.
Lukt terskel
0,6 mg/m3.
Brytningsindeks
1.4465 til 20 ºC.
Ph
7-8 til 20 ºC.
Stabilitet
Cyclohexen er ikke veldig stabil under lagring av lang tid. Eksponering for lys og luft kan forårsake peroksydproduksjon. Det er også uforenlig med sterke oksidasjonsmidler.
Reaksjoner
-Cycloalques opplever hovedsakelig tilsetningsreaksjoner, både elektrofile og frie radikaler.
-Reagerer med brom for å danne 1,2-dibromocyclohexan.
-Det oksiderer raskt i nærvær av kaliumpermanganat (KMNO4).
-Det er i stand til å produsere et epoksyd (cykloheksoksid) i nærvær av peroksibenzoinsyre.
Syntese
Cyclohexen produseres av Acid Cyclohexanol Catalysis:
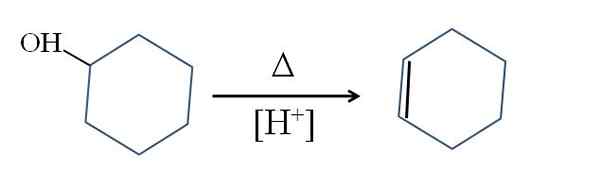 Dehydrering av cykloheksanol. Kilde: Gabriel Bolívar.
Dehydrering av cykloheksanol. Kilde: Gabriel Bolívar. Δ-symbolet representerer varmen som er nødvendig for å fremme utgangen fra OH-gruppen som et vannmolekyl i et surt medium (-OH2+).
Cyclohexen oppstår også ved delvis hydrogenering av benzen; Det vil si at to av dobbeltbindingene tilfører et hydrogenmolekyl:
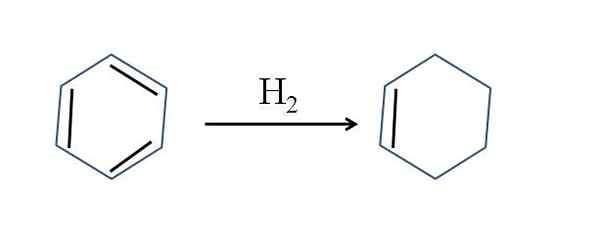 Delvis hydrogenering av benzen. Kilde: Gabriel Bolívar.
Delvis hydrogenering av benzen. Kilde: Gabriel Bolívar. Selv om reaksjonen virker enkel, krever den stor h2 og katalysatorer.
applikasjoner
-Det har nytteverdi som et organisk løsningsmiddel. I tillegg er det et råstoff for produksjon av adipinsyre, adipisk aldehyd, maleinsyre, cykloheksan og cykloheksylkarboksylsyre.
Kan tjene deg: radioaktivitet-Det brukes i produksjonen av cycloheksanklorid, forbindelse som brukes som mellomledd av fremstilling av farmasøytiske produkter og gni additiv.
-Cyclohexen brukes også i syntesen av cykloheksanon, råstoff for produksjon av medisiner, plantevernmidler, parfymer og fargestoffer.
-Cyclohexen griper inn i syntesen av aminocykloheksanol, en forbindelse som brukes som overflateaktivt middel og emulgator.
-I tillegg kan cyclohexen brukes til tilberedning i Butadieno -laboratoriet. Denne siste forbindelsen brukes til fremstilling av syntetisk gummi, i utdyping av bildekk, og brukes også til utdyping av akrylplast.
-Cyclohexen er råstoff for lysinsyntese, fenol, polykyloolefinharpiks og gummitilsetningsstoffer.
-Det brukes som en stabilisator med høye oktanbensiner.
-Griper inn i syntesen av vanntette belegg, filmer som er motstandsdyktige mot sprekker og bindende mapper for belegg.
Risiko
Cyclohexen er ikke en veldig giftig forbindelse, men det kan forårsake en rødhet i huden og øynene. Innånding kan produsere hoste og døsighet. I tillegg kan inntaket forårsake døsighet, pustevansker og kvalme.
Cyclohexen er lite absorbert i mage -tarmkanalen, så det forventes ikke alvorlige systemiske effekter på grunn av inntak. Den maksimale komplikasjonen er dens ambisjon for luftveiene, som kan produsere kjemisk lungebetennelse.
Referanser
- Joseph f. Chiang, og Simon Harvey Bauer. (1968). Molekylær struktur av cykloheksen. J. ER. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyclohexene: farer, syntese og struktur. Studere. Gjenopprettet fra: Studie.com
- Morrison, r. T. Og Boyd, r. N. (1987). Organisk kjemi. (5ta Utgave.). Redaksjonell Addison-Wesley Iberoamericana.
- Pubchem. (2019). Cyclohexene. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Kjemisk bok. (2019). Cyclohexene. Gjenopprettet fra: ChemicalBook.com
- Toksikologi datanettverk. (2017). Cyclohexene. Toxnet. Gjenopprettet fra: Toxnet.NLM.NIH.Gov
- Chemoksy. (s.F.). Den strukturelle formelen for cykloheksen er. Gjenopprettet fra: Chemoksy.com

