Cyclooxygenase -typer, reaksjon, hemmere
- 2657
- 561
- Oliver Christiansen
De Cyclooxygenases (Coxs), også kjent som prostaglandin H -syntase eller prostaglandin endoperoksydsynthesas, er oksygenase fettsyreenzymer som tilhører myeloperoxidase superfamilie og funnet i alle virveldyr dyr.
Cycoxygenases er bifunksjonelle enzymer, ettersom de har to forskjellige katalytiske aktiviteter: en cyklooxygenase -aktivitet og en annen peroksidase, som lar dem katalysere Bis-oksygenering og reduksjon av arachidonsyre for å danne prostaglandin.
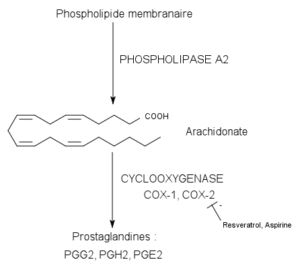 Katalisert reaksjon ved cycloxygenase-enzymer (kilde: Pancrat [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons)
Katalisert reaksjon ved cycloxygenase-enzymer (kilde: Pancrat [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons) De har ikke blitt funnet i planter, insekter eller i encellede organismer, men i virveldyrceller disse enzymet, vesiklene osv.
De første deteksjonene av produktene som ble syntetisert av cyclooxygenaser ble laget i sædvæsker, så det ble opprinnelig tenkt at det var stoffer produsert i prostata, og det var derfor de ble kalt "prostaglandiner".
I dag er det kjent at prostaglandiner blir syntetisert i alle vevene til virveldyr og til og med i organismer som ikke har prostatakjertler, og at de forskjellige isomerer av disse molekylene har forskjellige funksjoner i forskjellige fysiologiske og patologiske prosesser som feber, følsomhet for de Følsomhet for smerte eller alge, betennelse, trombose, mytogenese, vasodilatasjon og vasokonstriksjon, eggløsning. Renalfunksjon, etc.
[TOC]
Folkens
Eksistensen av to typer cyclooxygenaser mellom virveldyr er rapportert. Den første som ble oppdaget og renset er kjent som Cox-1 eller ganske enkelt Cox, og ble først renset i 1976 fra seminal vesikler av sauer og kyr.
Den andre cycloxigenase som ble oppdaget blant eukaryotene var COX-2, i 1991. Til dags dato har det blitt bevist at alle virveldyr, inkludert bruskfisk, beinfisk, fugler og pattedyr, har to gener som koder for Cox -enzymer.
Det kan tjene deg: soppsirkulasjon: næringsstoffer, stoffer, osmoreguleringEn av dem, Cox-1, koder for cyclooxigenase 1, som er konstitutivt, mens genet COX-2 koder for inducerbar cyclooxygenase.
Kjennetegn på både gener og deres enzymatiske produkter
COX-1 og COX-2-enzymer er ganske like, noe som forstås som 60-65% likhet mellom aminosyresekvensene.
Genene Cox-1 Ortologer (gener i forskjellige arter som har samme opprinnelse) i alle arter av virveldyr produserer Cox-1-proteiner som deler opptil 95% av identiteten til aminosyresekvensene deres, noe som også er sant for ortologene av COX-2, hvis produkter deler mellom 70 og 90% identitet.
Cnidarians og ascidias har også to gener Cox, Men disse er forskjellige fra andre dyr, så noen forfattere antar at disse genene kunne ha dukket opp i uavhengige dupliseringshendelser fra samme felles forfedre.
Cox-1
Gen Cox-1 veier omtrent 22 kb og er konstitutivt uttrykt for å kode COX-1-proteinet, som har omtrent 600 aminosyreavfall før det blir behandlet, da det har et hydrofobt signalpeptid etter hvis fjerning betaler et protein på omtrent 576 aminosyrer.
Dette proteinet er hovedsakelig i endoplasmatisk retikulum, og dens generelle struktur er i form av en homodimer, det vil si to identiske polypeptidkjeder som er assosiert for å danne det aktive proteinet.
COX-2
Gen Cox-2, derimot, veier omtrent 8 kb og ekspresjonen induseres av cytokiner, vekstfaktorer og andre stoffer. Dette koder for COX-2-enzymet som det har, inkludert signalpeptidet, 604 aminosyreavfall og 581 etter behandling.
Kan tjene deg: anaerob pustDette enzymet er også homodimerisk og er mellom endoplasmatisk retikulum og kjernefysisk pakket.
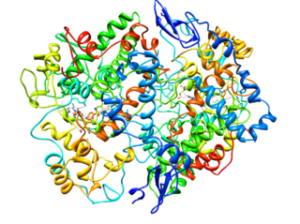 Molekylær struktur av type 2 Cycloxygenase (COX-2) (Kilde: Cytokrom C på engelsk Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons)
Molekylær struktur av type 2 Cycloxygenase (COX-2) (Kilde: Cytokrom C på engelsk Wikipedia [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons) Fra analysen av strukturene deres er det blitt bestemt at COX-1 og COX-2 enzym engelsk Epidermal vekstfaktor).
I denne modulen er ekstremt bevarte disulfidbindinger eller broer, som fungerer som "dimeriseringsdomenet" mellom de to polypeptidene til hvert homodimerisk enzym.
Proteiner har også amfipatiske propeller som letter forankring til et av membranlagene. I tillegg har det katalytiske domenet til begge to aktive steder, ett med cyclooxygenase -aktivitet og en annen med peroksidaseaktivitet.
Begge enzymer er ekstremt konserverte proteiner, og er blant forskjellige arter lite signifikante forskjeller med hensyn til mekanismene for dimerisering og forening til membranen, så vel som noen egenskaper ved deres katalytiske domener.
Cox -proteiner har i tillegg glykosyleringssteder som er avgjørende for deres drift, og som er absolutt bevart.
Reaksjon
Cycloxygenase-enzymer 1 og 2 er ansvarlige for å katalysere de to første trinnene i prostaglandinbiosyntese, som begynner med omdannelsen av arachidonsyre til forløpere av prostaglandiner kjent som hydroperoxi-endoperoxide PGG2.
For at disse enzymene skal utøve sine funksjoner, må de først aktiveres gjennom en prosess avhengig av deres peroxidase -aktivitet. Med andre ord, hovedaktiviteten avhenger av reduksjonen av et peroksydsubstrat (mediert av det aktive peroksidasestedet) slik at oksidasjonen av jernet assosiert med hemo -gruppen som fungerer som en kofaktor oppstår.
Det kan tjene deg: Monera Kingdom: Egenskaper, klassifisering og eksemplerOksidasjonen av hemogruppen forårsaker dannelse av en tyrosilradikal i den aktive setet cycloxygenase, som aktiverer enzymet og fremmer initiering av cyclooxygenase -reaksjonen. Denne aktiveringsreaksjonen kan bare oppstå en gang, da tyrosilradikalen regenereres under den siste reaksjonen av ruten.
Hemmere
Syklooxygenaser er involvert i syntesen av prostaglandiner, som er hormoner med funksjoner i beskyttelsen av tarmslimhinnen, i aggregeringen av blodplater og i regulering av nyrefunksjon, i tillegg til å delta i prosessene med betennelse, smerter og smerter og feber.
Med tanke på det faktum at disse enzymene er nøkkelen til produksjonen av disse hormonene, spesielt de som har å gjøre med inflammatoriske prosesser, har mange farmakologiske studier fokusert på hemming av cyklooxygenaser.
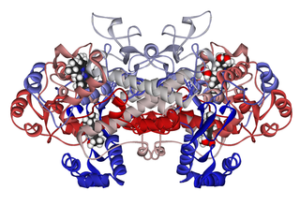 Molekylær struktur av cycloxigenase 1 koblet til ibuprofen (kilde: fvasconcellos 5. mai 2007 [Public Domain] via Wikimedia Commons)
Molekylær struktur av cycloxigenase 1 koblet til ibuprofen (kilde: fvasconcellos 5. mai 2007 [Public Domain] via Wikimedia Commons) Dermed har det blitt vist at virkningsmekanismen til mange ikke-steroide antiinflammatoriske medisiner har å gjøre med irreversibel eller reversibel (hemmende) acetylering av den aktive set-cyclooxigenase i disse enzymene.
Blant disse stoffene er Piroxicam, ibuprofen, aspirin, flurbiprofen, diclofenac, naproxen og andre.
Referanser
- Botting, r. M. (2006). Inhibitorer av cyclooxygenaser: mekanismer, selektivitet og bruk. Journal of Physiology and Pharmacology, 57, 113.
- Chandrasekharan, n. V., & Simmons, D. L. (2004). Cyclooxygenases. Genombiologi, 5 (9), 241.
- Fitzpatrick, f. TIL. (2004). Cyclooxygenase -enzymer: regulering og funksjon. Nåværende farmasøytisk design, 10 (6), 577-588.
- Kundu, n., Smyth, m. J., Samsel, l., & Fulton, til. M. (2002). Cyclooxygenase -hemmere blokkerer cellevekst, øker ceramid og hemmer cellesyklus. Brystkreftforskning og behandling, 76 (1), 57-64.
- Rauzer, ca. TIL., & Marnett, l. J. (2009). Cyclooxygenases: Strukturell og funksjonell innsikt. Journal of Lipid Research, 50 (supplement), S29-S34.
- Vane, J. R., Bakhle, og. S., & Botting, r. M. (1998). Cyclooxygenses 1 og 2. Årlig gjennomgang av farmakologi og toksikologi, 38 (1), 97-120.
- « Overvannsårsaker, effekter og løsninger
- De 101 beste mikrohistoriene for unge mennesker og voksne »

