Karboksylsyre
- 1249
- 292
- Theodor Anders Hopland
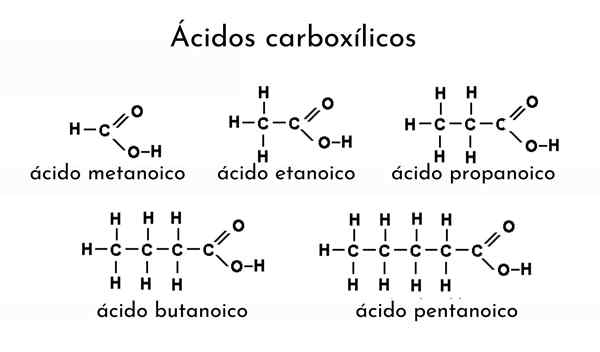
 Eksempler på karboksylsyrer
Eksempler på karboksylsyrer Hva er karboksylsyrer?
Han karboksylsyre Det er et begrep som tilskrives enhver organisk forbindelse som inneholder en karboksylgruppe. De kan også kalles organiske syrer, og er til stede i mange naturlige kilder. For eksempel, fra maur og andre insekter som gallerittbille, maursyre, er en karboksylsyre destillert.
Det vil si at en anthill er en kilde rik på maursyre. Også eddiksyre blir ekstrahert fra eddik, lukten av harsk smør skyldes smørsyre, Valeria -urter inneholder hjernesyre og fra hettene oppnådd kaprinsyre, alle disse karboksylsyrene.
Melkesyre gir den dårlige smaken av sur melk, og i noen fett og oljer er fettsyrene til stede. Eksemplene på naturlige kilder til karboksylsyrer er utallige, men alle deres tildelte navn er avledet fra ord på latin. Dermed på latin ordet Formica betyr "maur".
Siden disse syrene ble trukket ut i forskjellige kapitler i historien, var disse navnene vanlige, og konsoliderte seg i populærkulturen.
Formel
De Generell formel for karboksylsyre er -r -COOH, eller mer detaljer: R- (c = o) -oh. Karbonatomet er knyttet til to oksygenatomer, noe som forårsaker en reduksjon i dens elektroniske tetthet og følgelig en positiv delvis belastning.
Denne belastningen gjenspeiler karbonoksidasjonsstatus i en organisk forbindelse. I alle andre er karbon like rusten som i tilfelle av karboksylsyrer, denne oksidasjonen er proporsjonal med graden av reaktivitet av forbindelsen.
Av denne grunn har gruppen -COOH overvekt mot andre organiske grupper, og definerer den viktigste kullsyreholdige naturen og den viktigste kullsyreholdige kjeden til forbindelsen.
Derfor er det ingen syrederivater av aminer (R-NH2), men aminos avledet fra karboksylsyrer (aminosyrer).
Nomenklatur
Vanlige navn avledet fra latin for karboksylsyrer tydeliggjør ikke strukturen til forbindelsen, eller deres arrangement eller disponering av atomgruppene deres.
Gitt behovet for disse avklaringene, oppstår IUPAC -systematisk nomenklatur for å navngi karboksylsyrer.
Kan tjene deg: Bromin: Historie, struktur, elektronisk konfigurasjon, egenskaper, bruksområderDenne nomenklaturen styres av flere regler, og noen av disse er:
Regel 1
For å nevne en karboksylsyre, må navnet på dens alkan modifiseres ved å legge til "ICO" -suffikset. Dermed for etan (velg3-Ch3) Den tilsvarende karboksylsyren er etansyre (CH3-COOH, eddiksyre, det samme av eddik).
Et annet eksempel: For Cho3Ch2Ch2-Cooh El Alcano blir butan (CH3Ch2Ch2Ch3) og derfor utnevnes butansyre (smørsyre, det samme av harsk smør).
Regel 2
-COOH -gruppen definerer hovedkjeden, og antallet som tilsvarer hvert karbon telles fra karbonyl.
For eksempel Cho3Ch2Ch2Ch2-COOH er pentansyre, og teller fra en til fem karbonatomer til metyl (velg3). Hvis en annen metylgruppe er knyttet til det tredje karbonet, ville det være Cho3Ch2Ch (Ch3) Ch2-COOH, å være den resulterende nomenklaturen nå: 3-metylpentansyre.
Regel 3
Substituentene er foran med antall karbon de er koblet til. På samme måte kan disse substituentene være doble eller trippelkoblinger, og legge til "ICO" -suffikset likt til alkener og alkiner. For eksempel Cho3Ch2Ch2CH = chch2-COOH er nevnt som syre (cis eller trans) 3- heptenoic.
Regel 4
Når R -kjeden består av en ring (φ). Syren er nevnt fra og med navnet på ringen og slutter med det "karboksyliske" suffikset. For eksempel er φ-CooH kalt benzecenokarboksylsyre.
Karboksylsyrestruktur
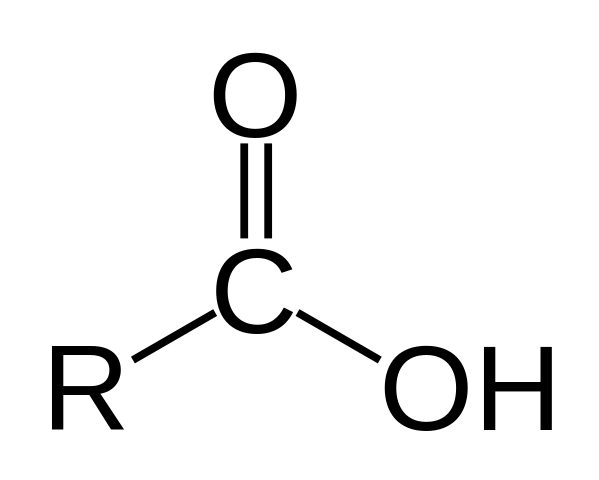 Struktur av en karboksylsyre. R er en hydrogen eller kullsyreholdig kjede.
Struktur av en karboksylsyre. R er en hydrogen eller kullsyreholdig kjede. I det øvre bildet er den generelle strukturen til karboksylsyre representert. Sidekjede R kan ha en hvilken som helst lengde eller ha alle slags substituenter.
Karbonatom har SP -hybridisering2, som lar deg godta en dobbeltbinding og generere koblingsvinkler på omtrent 120 º.
Derfor kan denne gruppen assimileres som en flat trekant. Det øvre oksygenet er rikt på elektroner, mens det nedre hydrogenet er dårlig i elektroner, og blir et syrehydrogen (elektronakseptor). Dette kan observeres i dobbeltbindingsresonansstrukturer.
Hydrogen er tilordnet en base, og av denne grunn tilsvarer denne strukturen en syreforbindelse.
Kan tjene deg: aminerKarboksylsyreegenskaper
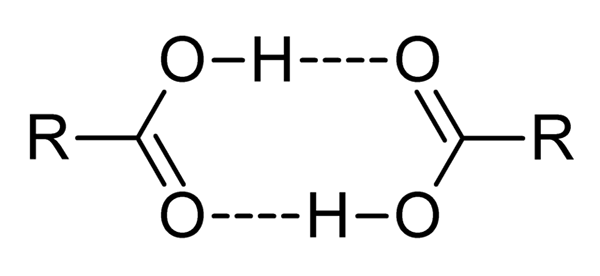
Karboksylsyrer er veldig polare forbindelser, intens lukt og med letthet av å effektivt samhandle med hverandre ved hydrogenbroer, som illustrert av det overlegne bildet.
Når to karboksylsyrer samhandler på denne måten, dannes dímeros, noen stabile nok til å eksistere i en gassfase.
Hydrogen- og diameterbroer fører til at karboksylsyrer har høyere kokepunkter enn vann. Dette er fordi energien som leveres i varmen, må fordampe ikke bare et molekyl, men til en dimer, også knyttet sammen av disse hydrogenbroene.
Små karboksylsyrer føler stor affinitet for vann og polare løsningsmidler. Når antallet karbonatomer er større enn fire, dominerer imidlertid den hydrofobe karakteren av R -kjedene.
I fast eller flytende fase spiller lengden på R -kjeden og substituentene som den har en viktig rolle. Når kjedene er veldig lange, samhandler de således gjennom London -spredningskreftene, som i tilfelle av fettsyrer.
Surhet
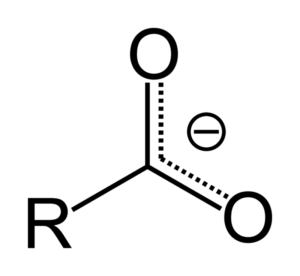
Når karboksylsyre donerer et proton, blir det karboksylatanionen, representert i det øvre bildet. I denne anion flyttes den negative belastningen mellom de to karbonatomene, stabiliserer den og derfor favoriserer reaksjonen å skje.
Hvordan varierer denne surheten fra en karboksylsyre til en annen? Det hele avhenger av surheten til protonet i OH -gruppen: jo dårligere i elektroner, jo mer syre.
Denne surheten kan økes hvis en av RA -kjedesubstituentene er en elektronegativ art (som tiltrekker eller trekker seg elektronisk tetthet fra omgivelsene).
For eksempel, hvis i Cho3-COOH erstattes en H av metylgruppen med et fluoratom (CFH2-COOH) Surhet øker betydelig fordi F trekker ut elektronisk tetthet fra karbonyl, oksygen og deretter hydrogen. Hvis alle H erstattes av F (CF3-COOH) surhet når sin maksimale verdi.
Kan tjene deg: hydrogen: historie, struktur, egenskaper og brukHvilken variabel bestemmer graden av surhet? PKtil. Jo lavere PKtil Og nærmere 1, er større syrens evne til å dissosiere i vann og på sin side farligere og skadelig. Fra forrige eksempel, CF3-COOH har den laveste PK -verdientil.
Bruker/anvendelser av karboksylsyrer
På grunn av den enorme variasjonen av karboksylsyrer, har hver av disse en potensiell anvendelse i bransjen, det være seg av polymerer, farmasøytisk eller mat.
Mat industri
- Tilsetningsstoffer.
- Konserveringsmidler (sorbinsyre og benzosyre).
- Alkalinitetsregulator for mange produkter.
- Produksjon av brus.
- Antimikrobielle midler før handlingen til antioksidanter. I dette tilfellet er trenden flytende antimikrobiell.
- Hovedingrediens av vanlig eddik (eddiksyre).
- Syremidlet i kullsyreholdige drinker og mat (sitronsyre og melkesyre).
- Assistent i modning av sveitsisk ost (propionsyre).
- Ost, chucrut, gjæret colm og brus (melkesyre).
Legemiddelindustrien
- Antipyretisk og smertestillende (acetylsalisylsyre).
- Aktiv i prosessen med aromasyntese, i noen medisiner (Butyric eller butansyre).
- Antimikotisk (benzosyre kombinert med salisylsyre).
- Aktiv for fremstilling av vitamin C medisiner (askorbinsyre).
- Soppmiddel (caprilic acid).
- Produksjon av noen avføringsmidler (hydroksybothanodium acid).
Andre bransjer
- Produksjon av plast og smøremidler (sorbinsyre).
- Produksjon av lakk, elastiske harpikser og gjennomsiktige lim (akrylsyre).
- Produksjon av malerier og lakker (linolsyre).
- Produksjon av såper, vaskemidler, sjampo, kosmetikk og metallrengjøringsprodukter (oleic acid).
- Tannpastaproduksjon (salisylsyre).
- Rayonacetatproduksjon, fotografiske filmer og løsningsmidler for maling (eddiksyre).
- Fargestoff og solbrun produksjon (metansyre).
- Fremstilling av smøremiddeloljer, vanntette materialer og sekantmalerier (palmitinsyre).
- Gummiproduksjon (eddiksyre).
- Gummiutdyping og galvanoplastikk.
- Løsemiddel.
- Parfymeproduksjon (benzosyre).
- Produksjon av myknere og harpikser (fotalyre).
- Polyester utdyping (tereftallic acid).
- Forberedelse av parafinlys (stearinsyre).
Referanser
- Graham Solomons t.W., Craig f. Yngel. Organisk kjemi. Karboksylsyrer og deres derivater (10. utgave., side 779-783). Wiley Plus.
- Organiske syrer. Naturalwellbeing kom seg.com
- Francis a. Tortoiseshell. Organisk kjemi. Karboksylsyrer. (Sjette utgave., Side 805-820). Mc Graw Hill.
- William Reusch. Karboksylsyrer. Gjenopprettet fra kjemi.MSU.Edu
- « Kjennetegn og risikofaktorer for biologisk mangfold i Mexico
- De 5 grenene av hovedbiotechnologien »

