Klorsyre (Hclo3)
- 5043
- 824
- Mathias Aas
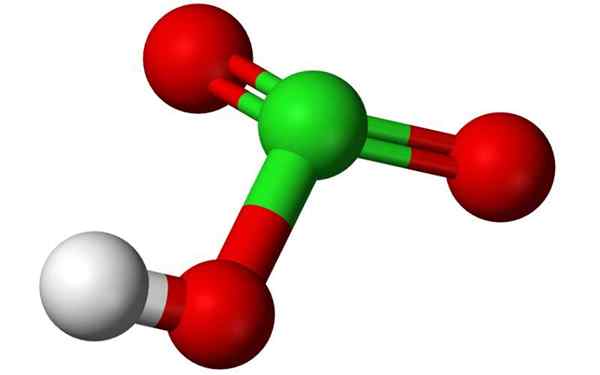
 Kjemisk struktur av klorsyre i en 3D -ballongmodell. Kilde: Benjah-BMM27, Wikimedia Commons
Kjemisk struktur av klorsyre i en 3D -ballongmodell. Kilde: Benjah-BMM27, Wikimedia Commons Hva er klorsyre?
Han klorsyre Det er en uorganisk forbindelse av Hclo -formelen3, En oksacid av klor og formell forløper av kloratsalter. Det er en sterk syre som er i stand til å donere et hydrogen til en akseptor eller base tronsted.
Forbindelsen oppnås med bariumklorat (barittklorat) med svovelsyre for å produsere bariumsulfat, vannoppløselig i henhold til følgende reaksjon:
Ba (clo3)2 + H2SW4 → 2HCLO3 + Baso4
En annen metode for å oppnå er oppvarming av hypoklorsyre for å oppnå klorosyre og hydrogenklorid i henhold til reaksjonen:
3HCLO → HCLO3 + 2HCl
Klorinsyren (Hclo3) er en kraftig oksidant gitt at den er i stand til å redusere til oksidasjonstilstander +3, +1 og -1. Det brukes til fremstilling av kloratsalter.
Den dekomponerer til konsentrasjoner større enn 30%. Det går også i stykker når den varmes opp, så det må holdes kaldt hele tiden, og alle glasskarene som brukes til å håndtere, må tidligere kjøles.
Fysiske og kjemiske egenskaper
- Klorsyre eksisterer bare i løsning. Det er en fargeløs væske uten karakteristisk aroma.
- Forbindelsen har en molekylvekt på 84.459 g/mol og en tetthet på 1 g/ml ved 25 ° C.
- Den har et kokepunkt over 100 ° C og en vannløselighet på 40 g per 100 ml av dette løsningsmidlet ved 25 ° C.
- Klorinsyre vil akselerere forbrenning av brennbare materialer og kan slå på flertallet i kontakt. Forbindelsen er etsende for metaller og vev.
Kan tjene deg: koprekkingSelvreaktivt
- Konsentrasjonene av klorsyre over 40% nedbrytning.
- Antimon sulfid og konsentrerte løsninger av klorisk syre reagerer med glødel.
- Arsen sulfid og konsentrerte oppløsninger av klorsyre reagerer med glødel.
- Reagerer med handlekraft, til og med eksploderer med andre metallsulfider, det vil si kobbersulfid.
- I kontakt med oksidable materialer, inkludert ammoniakk, kan reaksjoner være ekstremt voldelige.
- Filterpapiret tenner etter å ha senket det i saltsyre.
- Eksplosjoner er registrert av klorisk syreoppløsningsblandinger med metaller som antimon, vismut og jern. Dette skyldes dannelsen av eksplosive forbindelser, inkludert hydrogen.
Reaktivitet og farer
Klorsyre er en ustabil forbindelse. Å være en sterk syre, er det ekstremt farlig i tilfelle hudkontakt (det er etsende og irriterende), øyekontakt (irriterende) og i tilfelle inntak. Også det veldig farlig i tilfelle innånding.
En alvorlig overeksponering kan forårsake lungeskader, kvelning, tap av kunnskap eller død. Langvarig eksponering kan forårsake hudforbrenninger og magesår.
Innånding av overeksponering kan forårsake luftveisirritasjon. Betennelsen i øyet er preget av rødhet, vanning og kløe. Hudbetennelse er preget av kløe, peeling, rødhet og noen ganger ampules dannelse.
Stoffet er giftig for nyrer, lunger og slimhembraner. Gjentatt eller langvarig eksponering for stoffet kan forårsake skade på disse organene.
I tilfelle øyekontakt, må du bekrefte om kontaktlinser brukes og fjerne dem umiddelbart. Øynene skal skylles med rennende vann i minst 15 minutter, og holde øyelokkene åpne. Kaldt vann kan brukes. Ingen øyeark skal brukes.
Kan tjene deg: Acetonitril (C2H3N)Hvis kjemikaliet kommer i kontakt med klærne, beholder det så raskt som mulig, og beskytter egne hender og kropp. Plasser offeret under en sikkerhetsdusj.
Hvis kjemikaliet akkumuleres i offerets utsatte hud, for eksempel hendene, vaskes huden forurenset med rennende vann og ikke -slimete såpe mykt og forsiktig.
Du kan også nøytralisere syre med fortynnet natriumhydroksyd eller med en svak base som natriumbikarbonat. Hvis irritasjon vedvarer, må du søke lege. Vask de forurensede klærne før du bruker det igjen.
Hvis hudkontakt er alvorlig, bør den vaskes med en desinfiserende såpe og dekke huden forurenset med en antibakteriell krem.
I tilfelle innånding, bør offeret få lov til å stå i et godt ventilert område. Hvis innånding er alvorlig, må offeret evakueres til et trygt område så snart som mulig.
Løse tette klær, for eksempel skjortehals, belter eller slips. Hvis offeret er vanskelig å puste, må oksygen administreres. Hvis offeret ikke puster, blir det laget en gjenopplivning av munnen.
Det bør tas med i betraktningen at det kan være farlig for personen som gir hjelp til å gi munn til munn -gjenopplivning, når det inhalerte materialet er giftig, smittsomt eller etsende.
Ved inntak induserer det ikke oppkast. Løse tette klær, for eksempel skjortehals, belter eller bånd. Hvis offeret ikke puster, kan du gjenopplive munnen. I alle tilfeller bør det søkes øyeblikkelig legehjelp.
applikasjoner
Klorsyren brukes hovedsakelig til dannelse av kloratsalter, så som natrium, kalsium, magnesium, strontium, bly, kobber og sølvklor, så vel som protokloreat og kvikksølv percelore tilberedes ved bruk av klorsyre som reagent som en reagent som et reagens.
Kan tjene deg: Enzymatisk aktivitet: Enhet, måling, regulering og faktorerStabil forløper for klordioksid, brukes i elektrokjemi -produksjon av ammonium med høy renhet.
Hovedproduksjonen av klorsyre begynte under den industrielle revolusjonen i Europa og ble brukt til å produsere vinylklorid for PVC -rør.
En annen bruk for syre i mange mindre -skala -applikasjoner, inkludert husholdningsrengjøring, gelatinproduksjon og andre mattilsetningsstoffer, avkalkning og lærbehandling.
Referanser
- Klorsyre (S.F.). Gjenopprettet fra Weebly.com.
- Klorsyre (S.F.). Gjenopprettet fra ChemicalBook.com.

