Fosforsyre (H3PO3)
- 2247
- 329
- Prof. Oskar Aas
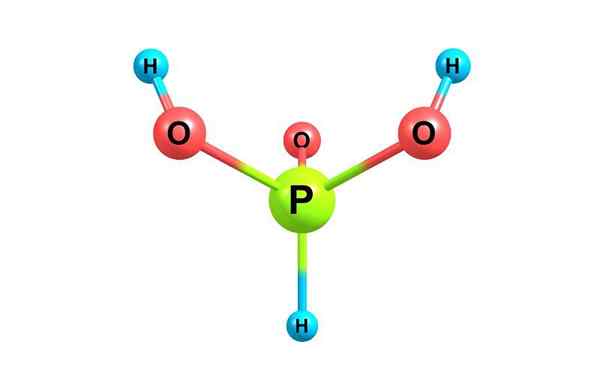
 Kjemisk struktur av fosforsyre. Med lisens
Kjemisk struktur av fosforsyre. Med lisens Hva er fosforsyre?
Han Fosforsyre, Også kalt ortofosfating syre, det er en kjemisk forbindelse av formel h3Po3. Det er en av de forskjellige oksygenerte syrene i fosfor og dens struktur presenteres i det øvre bildet.
Gitt den sammensatte formelen, kan dette skrives om som HPO (OH)2. Denne arten eksisterer i balanse med en mindre tautomer P (OH)3.
Anbefalingene fra IUPAC, 2005, er at sistnevnte kalles fosforsyre, mens dihydroksyformen kalles fosfonsyre. Bare reduserte fosforforbindelser er staver med en "bjørn" -avslutning.
Fosforsyre er en diprotsyre, dette betyr at den bare har evnen til å gi to protoner. Dette er fordi flertallet tautomer er h3Po3.
Når denne formen mister et proton, stabiliserer resonansen de dannede anionene. P (OH) Tautomero 3 har ikke fordelen av resonansstabilisering. Dette gjør eliminering av det tredje protonet mye vanskeligere.
Fosforsyre (h3Po3) Salg kalt fosfitter, som brukes som reduserende midler. Det tilberedes ved å løse opp tetrafosforisk heksoksid (P4ENTEN6) I henhold til ligningen:
P4ENTEN6 + 6 H₂O → 4 HPO (OH)2
Ren fosforsyre, h3Po3, Det er bedre utarbeidet av fosfor -trikloridhydrolyse, PCL3.
PCL3 + 3H2O → HPO (OH)2 + 3HCl
Den resulterende løsningen blir oppvarmet for å utvise HCl, og det gjenværende vannet fordamper til det vises 3Po3 krystallinsk fargerik når du avkjøles. Syre kan også oppnås ved vannvirkning på PBR3 eller pi3.
Fysiske og kjemiske egenskaper til Fosforsyre
- Fosforsyre er en hvit eller gul hygroskopisk tetrahedral krystall, med en aroma som ligner hvitløk.
Kan tjene deg: umettet løsning- H3Po3 Den har en molekylvekt på 82,0 g/mol og en tetthet på 1.651 g/ml.
- Forbindelsen har et smeltepunkt på 73 ° C og dekomponerer over 200 ° C.
- Det er løselig i vann, og kan oppløse 310 gram per 100 ml av dette løsningsmidlet. Det er også løselig i etanol.
- Det er en sterk syre med en PKA mellom 1,3 og 1,6.
- Oppvarming av fosforyre ved omtrent 200 ° C gjør det uforholdsmessig på fosforsyre og fosfin (pH3). Fosfin er en gass som normalt slår på spontant i luften.
4H3Po3 + Varme → pH3 + 3H3Po4
Reaktivitet og farer
Reaktivitet
- Fosforsyre er ikke en stabil forbindelse.
- Absorbere luftoksygen for å danne fosforsyre.
- Danner gule avsetninger i vandig løsning som spontant er brennbar når du tørker.
- REACT EXOTERMIKTISK med kjemiske baser (for eksempel: uorganiske aminer og hydroksider) for å danne salter.
- Disse reaksjonene kan generere farlig store mengder varme i små områder.
- Vannoppløsning eller fortynning av en konsentrert løsning med ekstra vann kan generere betydelig varme.
- Reagerer i nærvær av fuktighet med aktive metaller, inkludert strukturelle metaller som aluminium og jern, for å frigjøre hydrogen, en brennbar gass.
- Du kan starte polymerisering av visse alkener. Reagerer med cyanidforbindelser for å frigjøre gasshydrogencyanid.
- Det kan generere brennbare og / eller giftige gasser i kontakt med ditiokarbamater, isokianater, kjøpmenn, nitrider, nitriler, sulfider og sterke reduksjonsmidler.
- Ytterligere gassgenererende reaksjoner produseres med sulfitter, nitritter, tiosulfater (for å gi H2s og SO3), Dionitos (for å gi SO2) og karbonater (for å gi CO₂).
Det kan tjene deg: Einstenio (er): Struktur, egenskaper, innhenting, brukFarer
- Forbindelsen er etsende for øyne og hud.
- Øyekontakt kan føre til hornhinneskade eller blindhet.
- Hudkontakt kan gi betennelse og blemmer.
- Støvinnånding vil gi irritasjon av mage -tarmkanalen eller luftveiene, preget av svie, nysing og hoste.
- En alvorlig overeksponering kan forårsake lungeskader, kvelning, tap av kunnskap eller død.
Handling i tilfelle skade
- Forsikre deg om at medisinsk personell er klar over de involverte materialene og tar forholdsregler for å beskytte seg selv.
- Offeret må flyttes til et ferskt nettsted og ringe akuttmedisinsk tjeneste.
- Kunstig pust bør gis hvis offeret ikke puster.
- Munn til munn -metoden skal ikke brukes hvis offeret har inntatt eller inhalert stoffet.
- Kunstig pust utføres ved hjelp av en lommemaske utstyrt med en ensrettet ventil eller annen tilstrekkelig luftveisenhet.
- Oksygen bør administreres hvis pusting er vanskelig.
- Forurensede klær og sko må fjernes og isoleres.
- I tilfelle kontakt med stoffet, skyll huden eller øynene umiddelbart med rennende vann i minst 20 minutter.
- For lavere hudkontakt, bør materialet unngås på den uaktuelle huden.
- Hold offeret rolig og varmt.
- Effektene av eksponering (innånding, inntak eller hudkontakt) kan bli forsinket.
Bruk av Fosforsyre
- Den viktigste bruken av fosforsyre er produksjon av fosfitter som brukes i vannbehandling. Fosforsyre brukes også til å fremstille fosfitsalter, for eksempel kaliumfosfitt.
Kan tjene deg: Boyle Law- Fosfitter har vist effekt i kontrollen av en rekke planter.
- Spesielt er behandlingen ved injeksjon av bagasjerommet eller bladen, som inneholder fosforsyresalter, indikert som respons på infeksjoner på grunn av plantepatogener av fytoftotera og pythiumtype (produserer nedbrytningen av roten).
- Fosforsyre og fosfitter brukes som reduksjonsmidler i kjemisk analyse. En ny praktisk og skalerbar syntese av fenyleddelsyrer, gjennom reduksjonen som er katalysert av mandelinsyrejodid, er basert på generering av jodideksyre fra den katalytiske natriumjodid -sitteret fra den katalytiske natriumjodid. For dette brukes fosforsyre som støkiometrisk reduksjon.
- Det brukes som en ingrediens for produksjon av tilsetningsstoffer som brukes i poliindustrien (vinylklorid). Også estere av fosforsyre brukes i flere reaksjoner av organisk syntese.
Referanser
- Fosforsyre (H3PO3). Gjenopprettet fra Britannica.com.
- Musonsyre. Gjenopprettet fra EBI.Ac.Storbritannia.

