Yodhydrric Acid (HI) struktur, egenskaper og bruk

- 915
- 51
- Oliver Christiansen
Han iarhydronsyre Det er en vandig løsning av hydrogenjodid som er preget av dens høye surhet. En definisjon mer knyttet til den kjemiske terminologien og IUPAC, er at det er en hydrati, hvis kjemiske formel er HI.
For å skille det fra gassformede molekyler av hydrogenjodid, HI (G), er det imidlertid betegnet som HI (AC). Det er av denne grunn at det i kjemiske ligninger er viktig å identifisere miljøet eller den fysiske fasen der reagenser og produkter har vært. Likevel er forvirring mellom hydrogenjodid og iarklorsyre vanligvis vanlig.
 Iarhydronsyreioner. Kilde: Gabriel Bolívar.
Iarhydronsyreioner. Kilde: Gabriel Bolívar. Hvis de engasjerte molekylene blir observert i sin identitet, vil beryktede forskjeller mellom HI (G) og HI (AC) bli funnet. I HI (G) er det en H-I-kobling; Mens de er i hei (ac), er de faktisk et par ioner jeg- og h3ENTEN+ samhandle elektrostátisk (overlegen bilde).
På den annen side er HI (AC) en kilde til HI (G), siden den første er utarbeidet ved oppløsningen av det andre i vann. På grunn av dette, med mindre det er i en kjemisk ligning, kan HI også brukes til å også referere til iarchydrric acid. HI er et sterkt reduserende middel og en utmerket kilde til ioner i- I vandig medium.
[TOC]
Yodhydronsyrestruktur
Yodhydronsyre består som forklart av en løsning av HI i vann. Når han er i vannet, dissosierer Hi -molekyler fullstendig (sterk elektrolytt), og har opprinnelse fra ionene i- og h3ENTEN+. Denne dissosiasjonen kan være representert med følgende kjemiske ligning:
Hei (g) + h2Eller (l) => i-(AC) + H3ENTEN+(AC)
Hva ville være likeverdig hvis det er skrevet som:
Hei (g) + h2Eller (l) => Hei (AC)
Hi (AC) avslører imidlertid ikke i det hele tatt hva som har skjedd med de gassformige HI -molekylene; Det indikerer bare at de er i vandig medium.
Derfor består den sanne strukturen til HI (AC) av ioner i- og h3ENTEN+ omgitt av vannmolekyler som fukter dem; Jo mer konsentrert iarhydronsyre, desto lavere antall vannmolekyler uten proton.
Kan tjene deg: Boyle LawKommersielt er faktisk HI -konsentrasjonen 48 til 57% i vann; Mer konsentrert ville være ekvivalent med å ha en syre for røyking (og enda farligere).
På bildet kan det sees at anion i- Den er representert med en lilla sfære, og h3ENTEN+ Med hvite kuler og et rødt, for oksygenatom. Kationen h3ENTEN+ Presenterer molekylær geometri trigonal pyramide (sett fra et høyere plan på bildet).
Egenskaper
Fysisk beskrivelse
Fargeløs væske; Men du kan stille ut gulaktige og brune toner hvis du er i direkte kontakt med oksygen. Dette er fordi ioner jeg- De ender opp med å oksidere molekylært jod, jeg2. Hvis det er mye jeg2, Det er mer enn sannsynlig at triaduroanionen vil bli dannet, jeg3-, som flekker løsningen som brun.
Molekylmasse
127,91 g/mol.
Lukt
Acre.
Tetthet
Tettheten er 1,70 g/ml for 57%HI -løsningen; Siden varierer tettheten avhengig av de forskjellige konsentrasjonene av HI. Denne konsentrasjonen danner en azeotropisk (den er destillert som et enkelt stoff og ikke som en blanding) hvis relative stabilitet kan skyldes sin kommersialisering over andre løsninger.
Kokepunkt
57% Hi Azeotrope koker ved 127 ºC med et trykk på 1,03 bar (pass til minibank).
Pka
-1.78.
Surhet
Det er en ekstremt sterk syre, så mye at den er etsende for alle metaller og vev; Selv for gummi.
Dette er fordi H-I-koblingen er veldig svak, og lett brytes under vannioniseringen. I tillegg broer hydrogen- - Hoh2+ De er svake, så det er ingenting å forstyrre H3ENTEN+ reagere med andre forbindelser; det vil si h3ENTEN+ har "gratis", som i- som ikke tiltrekker seg for mye til hans motion.
Kan tjene deg: pycnerometerReduksjonsmiddel
HI er et kraftig reduserende middel, hvis hovedreaksjonsprodukt er jeg2.
Nomenklatur
Nomenklaturen til iarhydronsyre stammer fra det faktum at jod "fungerer" med en enkelt oksidasjonstilstand: -1. Og i tillegg indikerer navnet at det har vann i sin strukturelle formel [i-] [H3ENTEN+]. Dette er det eneste navnet, da det ikke er en ren forbindelse, men en løsning.
applikasjoner
Jodkilde i organisk og uorganisk syntese
Hei er en utmerket kilde til ioner jeg- for uorganisk og organisk syntese, og er også et kraftig reduksjonsmiddel. For eksempel brukes dens 57% vandige oppløsning for syntese av alkyljodider (som CHO3Ch2I) fra primære alkoholer. På samme måte kan en OH -gruppe erstatte i en struktur av en i.
Reduksjonsmiddel
Yodhydronsyre har blitt brukt til å redusere for eksempel karbohydrater. Hvis glukose oppløst i denne syren blir oppvarmet, vil den miste alle OH-gruppene sine, og oppnå som et produkt N-heksanhydrokarbon.
På samme måte har den blitt brukt til å redusere funksjonelle grupper av grafenark, slik at de kan funksjonaliseres for elektroniske enheter.
Cativa -prosess
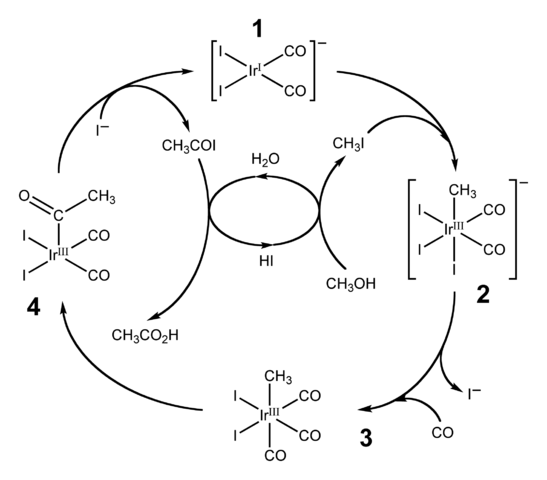 Diagram over den katalytiske syklusen for cativa -prosessen. Kilde: Ben Mills [Public Domain Domain].HI brukes også til industriell produksjon av eddiksyre gjennom cativa -prosessen. Dette består av en katalytisk syklus der metanolkarbonisering oppstår; det vil si til molekylet til CH3Å en karbonylgruppe blir introdusert, C = O, for å transformere til Cho Acid3COOH.
Diagram over den katalytiske syklusen for cativa -prosessen. Kilde: Ben Mills [Public Domain Domain].HI brukes også til industriell produksjon av eddiksyre gjennom cativa -prosessen. Dette består av en katalytisk syklus der metanolkarbonisering oppstår; det vil si til molekylet til CH3Å en karbonylgruppe blir introdusert, C = O, for å transformere til Cho Acid3COOH.
Trinn
Prosessen begynner (1) med organo-iridiumkomplekset [IR (CO)2Yo2]-, av firkantet flat geometri. Denne forbindelsen "mottar" metyljodid, CH3Jeg, produkt av cho surifisering3Å med 57% hei. Vann forekommer også i denne reaksjonen, og takket være det oppnås eddiksyre på slutten, samtidig som HI kan komme seg i det siste trinnet.
Kan tjene deg: kolloidI dette trinnet både gruppen -ch3 som -i blir med i Ididio Metal Center (2), og danner et oktaedrisk kompleks med en fasett sammensatt av tre ligander og. En av Yodos ender opp med å erstatte seg selv med et karbonmonoksidmolekyl, CO; Og nå (3) har oktaedralkomplekset en fasett sammensatt av tre co -ligander.
Deretter oppstår en omorganisering: -CH -gruppen3 Den er "utgitt" fra IR og blir med i det tilstøtende (4) for å danne en acetylgruppe, -Coch3. Denne gruppen slippes fra Iridido -komplekset for å koble til jodidionene og gi cho3COI, acetyljodid. Her gjenopprettes iridiumkatalysatoren, klar til å delta i en annen katalytisk syklus.
Til slutt, Cho3COI lider av en erstatning av i- For et H -molekyl2Eller, hvis mekanisme ender ved å frigjøre hei og eddiksyre.
Ulovlig syntese
 Efedrinreduksjonsreaksjon med rød fosfor og fosfor til metaphetamin. Kilde: methamphetamine_from_ephedrine_with_hi_ru.SVG: avledet Ring0 Trabajo: Materialscientist (Speaking) [Public Domain].Yodhydronsyre har blitt brukt til syntese av psykotropisk stoff som utnytter den høye reduktive kraften. For eksempel kan du redusere efedrin (en medisin for astmabehandling) i nærvær av rød fosfor, til metamfetamin (overlegen bilde).
Efedrinreduksjonsreaksjon med rød fosfor og fosfor til metaphetamin. Kilde: methamphetamine_from_ephedrine_with_hi_ru.SVG: avledet Ring0 Trabajo: Materialscientist (Speaking) [Public Domain].Yodhydronsyre har blitt brukt til syntese av psykotropisk stoff som utnytter den høye reduktive kraften. For eksempel kan du redusere efedrin (en medisin for astmabehandling) i nærvær av rød fosfor, til metamfetamin (overlegen bilde).
Det kan sees at en erstatning av OH -gruppen av I, etterfulgt av en annen erstatning for en H.
Referanser
- Wikipedia. (2019). Hydroiodic acid. Hentet fra: i.Wikipedia.org
- Andrews, Natalie. (24. april 2017). Bruken av hydriodic acid. Scienting. Gjenopprettet fra: Scienting.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Hydriodic acid. Gjenopprettet fra: Alfa.com
- Nasjonalt senter for bioteknologiinformasjon. (2019). Hydriodic acid. PubChem -database., CID = 24841. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Steven a. Hardinger. (2017). Illustrert ordliste over organisk kjemi: hydroiodic acid. Gjenopprettet fra: Chem.UCLA.Edu
- Reusch William. (5. mai 2013). Karbohydrater. Gjenopprettet fra: 2.Kjemi.MSU.Edu
- I Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Rødt Trapheneoksid ved kjemisk grafitisering. Doi: 10.1038/NCOMMS1067.
- « Memoristiske læringsegenskaper, typer og eksempler
- Bioprosesser egenskaper, typer, fordeler og stadier »

