Syrer og baser forskjeller, egenskaper, eksempler
- 3451
- 204
- Jonathan Carlsen
De Syrer og baser De er kjemiske forbindelser som ikke presenterer en enkelt definisjon, men flere, som er avhengige av egenskapene eller egenskapene som er tatt i betraktning. Generelt sett kan det sies at syrer er sure stoffer, mens basene er saponáceas eller såper.
De viktigste definisjonene, som Brönsted-Lowry eller Arrhenius, fokuserer mer på frigjøring av H-ioner3ENTEN+ (Hydronium) u oh-(hydroksyl) av disse stoffene. Enten i sine rene eller oppløste former i vann.
En definisjon som oppstår som en konsekvens av det ovennevnte er følgende: syrer oppløst i vann genererer oppløsninger med pH -verdier mindre enn 7, mens oppløste baser produserer løsninger med pH -verdier større enn 7. PH er nettopp en måte å uttrykke hvor sur eller basisk er en væske som tar hensyn til konsentrasjonen av H3ENTEN+.
Derfor har sure stoffer, for eksempel appelsinjuice, en pH mindre enn 7 og mange H -ioner3ENTEN+. Mens basene, for eksempel Legía, har en pH større enn 7 og mange OH -ioner-.
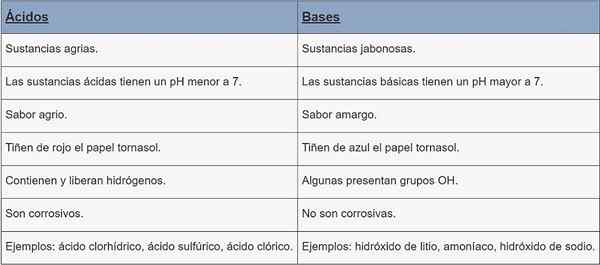
Syrer | Baser | |
Type stoff | Agrariske stoffer. | Jabonesas stoffer. |
Ph | pH mindre enn 7. | pH større enn 7. |
Smak | Sur. | Bitter. |
Flekker | Rødt vannskillepapir. | Maisstasol papir fargestoff blå. |
Kjennetegn | De inneholder og frigjør hydrogener. | Noen presenterer OH -grupper. |
Korrosjon | De er etsende. | De er ikke etsende. |
Eksempler | Saltsyre, svovelsyre, klorsyre. | Litiumhydroksyd, ammoniakk, natriumhydroksyd. |
Syrer
 Oransjejuice er en av de mest kjente syrerepresentantene i hverdagen vår
Oransjejuice er en av de mest kjente syrerepresentantene i hverdagen vår Syreegenskaper
Syrestoffer har visse egenskaper:
Sur smak
Syrer har en sur smak. Rutinemessig er en type smak betegnet med begrepet 'syre'. Dermed sies det at sitronsaften og væsken til noe tyggegummi er syrer, siden smakene er sure og sterke for ganen.
Rødt vannskillepapir
Syrer er stoffer som kan vri fargen på det blå til rødt spraypapir. Shortasol er en del av et sett med stoffer som kan endre farge avhengig av graden av surhet eller grunnleggende miljø der de blir funnet. Disse stoffene kalles pH -indikatorer.
Kan tjene deg: Coligative Properties of SolutionsDe inneholder og frigjør hydrogener
Syrene er kjemiske forbindelser som har det hydrogenkjemiske elementet (H), som gir det sin surhetskarakteristikk.
Mange andre stoffer inneholder også hydrogen, men de kan ikke frigjøre det som det skjer med syrer. Når du frigjør, er hydrogen i form av ion eller cation+. Disse h+, Når de møter vannmolekylene, blir de tilsatt disse for å danne H -ionene3ENTEN+.
De transporterer elektrisk strøm
På grunn av H -atomer+ Som frigjøres når syrer i vann blir oppløst, er disse i stand til å transportere strøm ved bruk av batterier eller batterier.
De er etsende
Det er sterke syrer som er veldig etsende. Derfor bør kontakt med dem unngås, siden de kan forårsake alvorlig fysisk skade. Selv svake syrer, ved veldig høye konsentrasjoner, som eddik (eddik) kan brenne huden og svelget hvis vaporene deres er pustet.
Sterk og svak
Sterke syrer gir en stor konsentrasjon av H -ioner3ENTEN+ Når de oppløses i vannet. Det sies at hydrogenatomene med sterke syrer lett dissosierer. I mellomtiden frigjør svake syrer få hydrogenatomer og produserer derfor en lavere konsentrasjon av H -ioner3ENTEN+.
Sterke syrer har en veldig lav pH, som avhengig av konsentrasjon og syrekraft, kan det være 1 eller mindre. I stedet har svake syrer en høyere sur pH, som for eksempel kan være 4 eller 5.
Sterke syrer har en lukt som gir en brennende følelse. I mellomtiden presenterer ikke svake syrer denne typen lukt, selv i noen tilfeller har de behagelig lukt. Imidlertid er det mange unntak, så de anbefales ikke å lukte selv svake syrer.
Kan tjene deg: jernoksid (iii): struktur, nomenklatur, egenskaper, brukSterke syrer er gode elektrisitetstransportører. Tvert imot, svake syrer er dårlige ledere av strøm ved å frigjøre få H -atomer+.
Sterke syrer er i stand til å angripe metaller, for eksempel sink, og danner et stort antall hydrogenbobler. Denne reaksjonen er ikke produsert av svake syrer.
Eksempler på syrer
Sterke syrer
-HCl: saltsyre
-H2SW4: svovelsyre
-HBR: Bromhydronsyre
-Hei: Yodhydronsyre
-Hno3: salpetersyre
-Hclo4: Perklorsyre
-Hclo3: Klorsyre
Svake syrer
-Ch3COOH: eddiksyre
-Hno2: Lystgass
-H2Co3: Kullsyre
-H3Po4: fosforsyre
-C3H5O (COOH): sitronsyre
-HF: Fluorhydronsyre
-H2SW3: Svovelsyre
Baser
 Ammoniakk er et grunnleggende stoff
Ammoniakk er et grunnleggende stoff Baseegenskaper
Basene presenterer følgende egenskaper:
-De produserer en tyktflytende eller såpefølelse i fingrene, noe som får objektene til å bli tatt av hendene til å bli glatte.
-De har en bitter smak.
-De kan reagere med syrer, og produserer dannelse av forbindelser som kalles salter. I noen tilfeller kan disse utfelle eller synke ned i vannet. I reaksjonen av en base med en syre dannes vann også.
-De snur fargen på det blå spirende papiret, noe som indikerer at løsningen har en pH større enn 7 eller alkalisk.
-Noen baser som er til stede i sine kjemiske formel OH -grupper, kalt hydroxilli, som dannes av et hydrogenatom og et oksygenatom.
Sterk og svak
Sterke baser er kjemiske forbindelser som presenterer en eller flere OH -grupper i sin kjemiske struktur, som når de kommer i kontakt med vann, får en negativ belastning, OH-.
I mellomtiden er de svake basene ikke til stede i sine kjemiske formelhydroksilgrupper. Imidlertid produserer svake baser når du reagerer med vann også ioner eller anioner oh-.
Sterke baser, for eksempel natriumhydroksyd, har veldig høye pH -verdier, nær 14. I mellomtiden har svake baser lavere pH, for eksempel ammoniakk, som har en pH på 11.
Kan tjene deg: Kokende: konsept, typer og eksemplerSterke baser brukes i hjem for å avdekke avløp. Slik er tilfellet med kaliumhydroksid. I mellomtiden brukes svake baser i rengjøringsarbeid, for eksempel ammoniakk som er til stede i mange rengjøringsmidler.
Eksempler på baser
Sterke baser
-Lioh: Litiumhydroksyd
-NaOH: natriumhydroksyd
-KOH: Kaliumhydroksid
-RBOH: Rubidio hydroxide
-CSOH: Cesiumhydroksid
-Sr (OH)2: Strontiumhydroksyd
-Ba (oh)2: Bariumhydroksyd
Svake baser
-NH3: ammoniakk
-NHET2: dietylamin
-NH2Ch3: Metilamin
-C5H5N: Pyridin
Forskjeller mellom syrer og baser
Ioner som frigjør
Syrer frigjør H -atomer+ eller h3ENTEN+ Når de oppløses i vannet. I mellomtiden frigjør basene eller produserer i kontakt med vannioner oh-.
PH -verdier
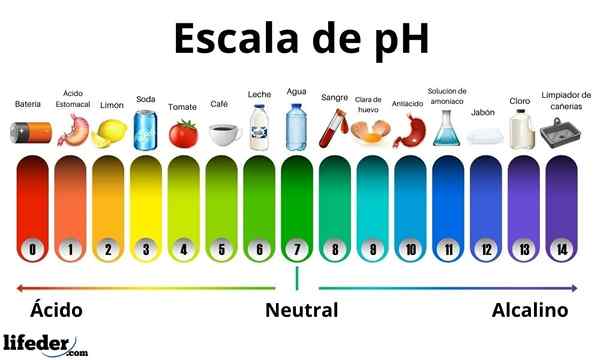
Syrer har en pH -verdi mellom 0 og 7. I mellomtiden har basene en pH -verdi mellom 7 og 14. Derfor snur syrer fargen på spirapapiret og basene blir det i blått.
Treningsreaksjoner
Syrer stammer fra reaksjonen av ikke -metalliske elementeroksider, for eksempel klor, svovel, etc., Med vann, eller de også dannes når hydrogen kombineres med et ikke -metallisk element, og deretter løses den dannede forbindelsen i vann (HF, HCl, HBR, etc.).
Basene produseres ved oksydreaksjonen til et metall, for eksempel jern, kobber, magnesium, etc., Med vann. Det må huskes at et oksid er kombinasjonen av oksygenatomer med et hvilket som helst annet kjemisk element.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (11. februar 2020). Syredefinisjon og eksempel. Gjenopprettet fra: Thoughtco.com
- Science Explorers. (31. juli 2018). Lære barn om syrer og baser. Gjenopprettet fra: ScienceExplorers.com
- Utarbeide eksemplap. (2013). Syreegenskaper. Gjenopprettet fra: eksemplarisk.com
- Lumen kjemi for ikke-major. (s.F.). Egenskaper til syrer og baser. Gjenopprettet fra: kurs.Lumenarning.com
- Clark Jim. (2013). Sterke og svake baser. Gjenopprettet fra: Chemguide.co.Storbritannia
- « Flora og fauna av den ecuadorianske Sierra -representative arten
- Metodologiske rammer hvordan du skriver det, struktur, eksempler »

