Klorhistorie, egenskaper, struktur, risikoer, bruker

- 1527
- 16
- Theodor Anders Hopland
Han Klor Det er et kjemisk element som er representert av CL -symbolet. Det er den andre av halogenene, som ligger under fluoren, og er også det tredje mest elektronegative elementet av alle. Hans navn stammer fra den gulaktige grønne fargen, som er mer intens enn fluor.
Populært når noen lytter til navnet sitt hva som først mener er i blekingsproduktene for klærne, og i vannet i bassengene. Selv om klor fungerer effektivt i slike eksempler, er det ikke dens gass, men forbindelsene (spesielt hypokloritt) som utøver avfarging og desinfeksjonsmiddelvirkning.
 Rund kolbe med gassformig klor inni. Kilde: Larenmclane [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Rund kolbe med gassformig klor inni. Kilde: Larenmclane [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] I det øvre bildet vises en rund kolbe med gassformig klor. Dens tetthet er større enn luften, noe som forklarer hvorfor den forblir i kolben og ikke slipper ut mot atmosfæren; Som med andre lettere gasser, for å si helium eller nitrogen. I denne tilstanden er det et ekstremt giftig stoff, ettersom det produserer saltsyre i lungene.
Det er grunnen til at elementær eller gassformig klor ikke har for mange bruksområder, mer enn i en viss syntese. Imidlertid dekker forbindelsene, enten salter eller klorerte organiske molekyler, et godt repertoar av bruk.
Det er også atomer i form av kloridanioner i kroppene våre, og regulerer natrium, kalsium og kaliumnivå, så vel som i magesaft. Hvis ikke, vil natriumkloridinntaket være enda mer dødelig.
Klor forekommer gjennom saltlakeelektrolyse, rik på natriumklorid, industriell prosess der natrium og hydrogenhydroksyd også oppnås. Og fordi havene er en nesten uuttømmelig kilde til dette saltet, er potensielle reserver av dette elementet i hydrosfæren veldig store.
[TOC]
Historie
Først nærmer seg
På grunn av den høye reaktiviteten i gassformig klor, mistenkte gamle sivilisasjoner aldri deres eksistens. Imidlertid var forbindelsene deres en del av kulturen for menneskeheten fra i går; Historien begynte å knytte seg til vanlig salt.
På den annen side oppsto klor fra vulkanutbrudd og når noen oppløst gull i kongelig vann; Men ingen av de første tilnærmingene var nok til å formulere ideen om at denne gulaktige grønne gassen var et sammensatt element.
Oppdagelse
Oppdagelsen av klor tilskrives den svenske kjemikeren Carl Wilhelm Scheele, som i 1774 gjorde reaksjonen mellom det pyrolusittiske mineral og saltsyre (da kalt muriatinsyre).
Scheele blir med æren siden han var den første forskeren som studerte egenskapene til klor; Selv om han tidligere har blitt anerkjent (1630) av Jan Baptist Van Helmont.
Eksperimentene som Scheele oppnådde observasjonene hans er interessante: Han evaluerte den avfargede virkningen av klor på rødlig og blålige blomsterblomster, så vel som i bladene til planter og insekter som døde øyeblikkelig.
Han varslet også sin høye reaktive mot metaller, hans kvelende lukt og uønsket effekt på lungene, og at når han oppløst i vann, økte surheten hans.
Oimuriatic acid
Da betraktet kjemikalier som en syre for alle de forbindelsene som hadde oksygen; Så de savnet kloren skulle være et gassformig oksid. Det var slik at de kalte det 'oksyuriatinsyre' (muriatinsyreoksid), navn myntet av den berømte franske kjemikeren Antoine Lavoisier.
Så, i 1809, prøvde Joseph Louis Gay-Lussac og Louis Jacques Thénard å redusere denne karbonsyre; reaksjon oppnådd av metaller fra oksydene deres. På denne måten ønsket de å trekke ut det kjemiske elementet fra den påståtte oksimuriatsyre (som de kalte 'Deflistic Air of Muriatic Acid'.
Imidlertid mislyktes Gay-Lussac og Thénard i sine eksperimenter; Men de lyktes når de vurderte at nevnte gulaktig grønn gass skulle være et kjemisk element og ikke en forbindelse.
Anerkjennelse som et element
Anerkjennelsen av klor som et kjemisk element var takket være Sir Humphry Davy, som i 1810 utførte sine egne eksperimenter med kullelektroder og konkluderte med at det faktisk var et slikt oksid av muriatinsyre.
Og i tillegg var det Davy som myntet navnet 'Chlorine' for dette elementet fra det greske ordet 'Chloros', som betyr gulaktig.
Da de studerte de kjemiske egenskapene til klor, ble det funnet at mange av forbindelsene deres hadde saltvanns natur; Derfor kalte de ham som en 'halogen', som betyr salgsformator. Deretter ble begrepet halogen brukt med de andre elementene i samme gruppe (F, BR og I).
Michael Faraday klarte til og med å flytende2· H2ENTEN.
Kan tjene deg: effektiv kjernefysisk belastningResten av klorhistorien er knyttet til dens desinfeksjonsmiddel og blekingsegenskaper, til utvikling av den industrielle prosessen med saltlakeelektrolyse for å produsere enorme mengder klor.
Fysiske og kjemiske egenskaper
Fysisk utseende
Det er en ugjennomsiktig gulaktig grønn tett gass, en irriterende dekar lukt (en superintensifisert versjon av kommersiell klor) og er også ekstremt giftig.
Atomnummer (z)
17
Atomvekt
35,45 u.
Med mindre annet er angitt, tilsvarer resten av egenskapene størrelser målt for molekylær klor, CL2.
Kokepunkt
-34.04 ºC
Smeltepunkt
-101,5 ºC
Tetthet
-Under normale forhold, 3,2 g/l
-Bare ved kokepunktet, 1.5624 g/ml
Merk at flytende klor er omtrent fem ganger mer enn gassen. Tettheten til dampen er også 2,49 ganger større enn luften. Det er grunnen til at klor i det første bildet ikke har en tendens til å flykte fra den runde kolben, siden det å være tettere enn luften ligger i bakgrunnen. Denne funksjonen gjør fortsatt en farligere gass.
Fusjonsvarme
6.406 kJ/mol
Fordampningsvarme
20.41 kJ/mol
Molar varmekapasitet
33,95 j/(mol · k)
Vannløselighet
1,46 g/100 ml ved 0 ºC
Damptrykk
7,67 atm ved 25 ºC. Dette trykket er relativt lavt sammenlignet med andre gasser.
Elektronegativitet
3.16 på Pauling -skalaen.
Ioniseringsenergier
-Først: 1251,2 kJ/mol
-For det andre: 2298 kJ/mol
-Tredje: 3822 kJ/mol
Termisk ledningsevne
8,9 · 10-3 W/(m · k)
Isotoper
Klor forekommer i naturen først og fremst som to isotoper: 35CL, med en overflod på 76%, og 37CL, med en overflod på 24%. Dermed er atomvekten (35,45 U) et gjennomsnitt av atommassene av disse to isotoper, med sine respektive prosentandeler av overflod.
Alle klor radioisotoper er kunstige, blant dem 36CL som den mest stabile, med en halvliv på 300 000 år.
Oksidasjonstall
Klor kan ha flere tall eller oksidasjonstilstander når det er en del av en forbindelse. Som et av de mest elektronegative atomer i den periodiske tabellen, har det vanligvis negative oksidasjonstall; Bortsett fra når det går med oksygen eller fluor, i henholdsvis oksider og fluorider, må den "miste" elektroner.
I sin oksidasjonstall antas eksistensen eller tilstedeværelsen av ioner med samme belastningsstørrelse. Dermed har vi: -1 (CL-, Den berømte kloridanionen), +1 (CL+), +2 (CL2+), +3 (CL3+), +4 (CL4+), +5 (CL5+), +6 (CL6+) og +7 (CL7+). Av alt er -1, +1, +3, +5 og +7 er de vanligste som finnes i klorerte forbindelser.
For eksempler, i CLF og CLF3 Oksidasjonstallene for klor er +1 (CL+F-) og +3 (CL3+F3-). I CL2Eller, dette er +1 (CL2+ENTEN2-); Mens du er i CLO2, Cl2ENTEN3 og cl2ENTEN7, Sønn +4 (CL4+ENTEN22-), +3 (CL23+ENTEN32-) og +7 (CL27+ENTEN72-).
I alle klorider, derimot, har klor oksidasjonsnummer på -1; Som i tilfelle av NaCl (Na+Cl-), Hvor det er gyldig å si at CL eksisterer- Gitt den ioniske naturen til dette saltet.
Elektronisk struktur og konfigurasjon
Klormolekyl
 Diatomisk klormolekyl representert med en romfyllingsmodell. Kilde: Benjah-BMM27 via Wikipedia.
Diatomisk klormolekyl representert med en romfyllingsmodell. Kilde: Benjah-BMM27 via Wikipedia. Kloratomer i sin basaltilstand har følgende elektroniske konfigurasjon:
[NE] 3S2 3p5
Derfor har hver av dem syv elektroner i Valencia. Med mindre de er overbelastet med energi, vil det være individuelle atomer i rommet, som om de var grønne klinkekuler. Hans naturlige tendens er imidlertid å danne kovalente bindinger mellom dem, for å fullføre sine oktetter av Valencia.
Merk at de knapt trenger et elektron for å ha åtte valenselektroner, slik at de danner en enkelt enkel lenke; Dette er den som blir med to CL -atomer for å lage CL -molekylet2 (Øvre bilde), CL-CL. Det er grunnen til at klor under normale og/eller landlige forhold er en molekylær gass; Ikke -monoatomisk, som tilfellet er med edelgasser.
Intermolekylære interaksjoner
Molecula Cl2 Den er homonukleær og apolar, så dens intermolekylære interaksjoner styres av spredningskreftene i London og dets molekylære masser. I en brusfase, avstanden CL2-Cl2 Det er relativt kort sammenlignet med andre gasser som, tilsatt massen, gjør den til en gass tre ganger mer enn luften.
Lys kan begeistre og fremme elektroniske overganger i molekylære orbitaler i CL2; Følgelig vises den karakteristiske gulaktig grønne fargen. Denne fargen intensiveres i flytende tilstand, og forsvinner deretter delvis når den stivner.
Kan tjene deg: svake baserNår temperaturen går ned (-34 ºC), CL-molekyler2 De mister kinetisk energi og avstanden CL2-Cl2 reduseres; Derfor er de sammenhengende og ender opp med å definere flytende klor. Det samme skjer når systemet (-101 ºC) er ytterligere avkjølt, nå med CL-molekylene2 Så sammen som definerer en ortorrombisk krystall.
At det er klorgrystaller, er en indikasjon på at deres spredende krefter er tilstrekkelig retning til å skape et strukturelt mønster; Dette er, molekylære lag av CL2. Separasjonen av disse lagene er slik at selv under et trykk på 64 GPa er dens struktur modifisert, og heller ikke viser elektrisk ledende.
Hvor er det og skaffer seg
Kloridsalter
 Halitas robuste krystaller, bedre kjent som vanlig eller bordsalt. Kilde: Foreldre Géry [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Halitas robuste krystaller, bedre kjent som vanlig eller bordsalt. Kilde: Foreldre Géry [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Klor i sin gassform. Disse kloridene er godt spredt over jordskorpen, og i tillegg etter millioner av år med å bli dratt av regnene, er havene og havene berikende.
Blant alle klorider er NaCl del mineral halita (overlegen bilde) det vanligste og rikelig; etterfulgt av Silvina, KCL og Carnalita, MGCL -mineraler2· KCl · 6H2ENTEN. Når vannmassene fordamper ved at solens virkning forlater ørkenens saltsjøer, hvorav NaCl kan trekkes ut direkte som råstoff for klor.
Saltlakeelektrolyse
NaCl løses opp i vann for å produsere en saltlake (26%), som elektrolyse blir utsatt for en kloralkalincelle. Det foregår to semi -reaksjoner i anoden og katodekommer:
2cl-(Ac) => cl2(g) + 2e- (Anode)
2H2Eller (l) + 2e- => 2OH-(AC) + H2(g) (katode)
Og den globale ligningen for begge reaksjonene er:
2NaCl (AC) + 2H2Eller (l) => 2naoh (ac) + h2(g) + cl2(g)
Som reaksjonen finner sted, naioner+ Dannet ved anoden vandrer de til katode -rommet og krysser en permeabel asbestmembran. Av den grunn er NaOH på høyre side av den globale ligningen. Begge gasser, CL2 og h2, De er samlet fra henholdsvis anoden og katoden.
Det nedre bildet illustrerer det nye skrevet:
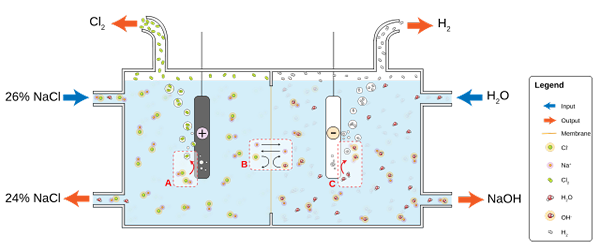 Diagram for klorproduksjon gjennom saltlakeelektrolyse. Kilde: Jkwchui [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Diagram for klorproduksjon gjennom saltlakeelektrolyse. Kilde: Jkwchui [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Merk at konsentrasjonen av saltlaken på slutten avtar med 2% (den går fra 24 til 26%), noe som betyr at en del av CL- Originaler forvandlet til CL -molekyler2. Til slutt har industrialiseringen av denne prosessen gitt en metode for å produsere klor, hydrogen og natriumhydroksyd.
Sur oppløsning av pyrolusitt
Som nevnt i historiedelen, kan den gassformige klor produseres ved å løse opp prøver av pyrolusittmalm med saltsyre. Følgende kjemiske ligning viser produktene oppnådd fra reaksjonen:
Mne2(S) + 4HCl (AC) => MCL2(AC) + 2H2Eller (l) + cl2(g)
Legeringer
Det er ingen klorlegeringer av to enkle grunner: Gassøse molekyler kan ikke fanges blant metallkrystaller, og disse er også veldig reaktive, så de vil reagere umiddelbart med metaller for å produsere sitt respektive klorid.
På den annen side er ikke klorider ønskelig, fordi de når de er oppløst i vann, utøver en saltvannseffekt som fremmer korrosjon i legeringer; Og derfor oppløses metaller for å danne metallklorider. Korrosjonsprosessen for hver legering er forskjellig; Noen er mer mottagelige enn andre.
Klor er følgelig ikke et godt tilsetningsstoff for legeringer i det hele tatt; heller ikke som cl2 heller ikke som cl- (Og atomene ville være veldig reaktive slik at de til og med kan eksistere).
Risiko
Selv om løseligheten av klor i vann er lav, er det nok å produsere i fuktigheten i huden vår og øynene saltsyre, som ender opp med å korrodere vevene som forårsaker alvorlige irritasjoner og til og med tap av syn.
Enda verre er å puste sine gulaktige grønne damper, siden en gang i lungene igjen genererer det syrer og skader lungevevet. Med dette opplever personen hals smerter, hoste og pustevansker på grunn av væskene som dannes i lungene.
Hvis det er en klorflukt, står den overfor en spesielt farlig situasjon: luft kan ikke bare "feie" damper; Bli der til de reagerer eller spredes sakte.
Kan tjene deg: presisjonsbalanse: egenskaper, funksjoner, deler, brukI tillegg til dette er det en sterkt oksiderende forbindelse, slik at flere stoffer kan reagere eksplosivt med ham på den minste kontakt; Som med stålull og aluminium. Det er grunnen til at der det er en lagret klor, må alle nødvendige hensyn tas for å unngå brannrisiko.
Ironisk nok, mens gassformig klor er dødelig, er kloridanionen ikke giftig; Det kan konsumeres (i moderasjon), brenner ikke eller reagerer bortsett fra med fluor og andre reagenser.
applikasjoner
Syntese
Cirka 81 % av gassformig klor som produseres årlig er bestemt for syntese av organiske og uorganiske klorider. Avhengig av graden av kovalens av disse forbindelsene, kan klor finnes som bare CL-atomer i klorerte organiske molekyler (med C-CL-bindinger), eller som CL-ioner- I noen få kloridsalter (NaCl, CACL2, Mgcl2, etc.).
Hver av disse forbindelsene har sine egne applikasjoner. For eksempel kloroform (CHCL3) og etylklorid (CH3Ch2CL) er løsningsmiddel som har blitt brukt som inhalasjonsbedøvelse; Diclorometano (CH2Cl2) og karbontetraklorid (CCL4), For deres del, er de løsemiddel som er mye brukt i organiske kjemilaboratorier.
Når disse klorerte forbindelsene er flytende, er mesteparten av tiden bestemt som løsningsmidler for organiske reaksjoner betyr.
I andre forbindelser representerer tilstedeværelsen av kloratomer en økning i dipolmomentet, slik at de i større grad kan samhandle med en polar matrise; en dannet av proteiner, aminosyrer, nukleinsyrer osv., Biomolekyler. Dermed har klor også papir i syntesen av medisiner, plantevernmidler, insektmidler, soppdrepende midler, etc.
Når det gjelder uorganiske klorider, brukes de vanligvis som katalysatorer, råstoff for å oppnå metaller ved elektrolyse eller CL -ionekilder-.
Biologisk
Gassformig eller elementær klor har ingen rolle innen levende vesener enn å ødelegge vevene deres. Dette betyr imidlertid ikke at atomene deres ikke kan finnes i kroppen. For eksempel CL -ioner- De er veldig rikelig i det cellulære og ekstracellulære mediet, og hjelper til med å kontrollere NA -ionnivåene+ og ca2+, for det meste.
På samme måte er saltsyre en del av magesaften som maten fordøyes i magen; dets CL -ioner-, I selskap med h3ENTEN+, Definer pH nær 1 av disse sekresjonene.
Kjemiske våpen
Tettheten av gassholdig klor gjør det til et dødelig stoff når det blir sølt eller helles i lukkede eller åpne områder. Å være tettere enn luft, en strøm av den drar ikke lett klor, så den gjenstår i en betydelig tid før den til slutt sprer seg.
I første verdenskrig ble for eksempel denne kloren brukt i slagmarkene. Når han ble løslatt, snek han seg inn i skyttergravene for å kvele soldatene og tvinge dem til å gå til overflaten.
Desinfeksjonsmiddel
 Bassengene kloroniseres for å unngå reproduksjon og spredning av mikroorganismer. Kilde: Pixabay.
Bassengene kloroniseres for å unngå reproduksjon og spredning av mikroorganismer. Kilde: Pixabay. De kloroniserte oppløsningene, de der gassform. De har blitt brukt til å desinfisere åpne sår for å eliminere patogene bakterier.
Bassengvann kloroniseres nøyaktig for å eliminere bakterier, mikrober og parasitter som kan huse det. For dette formålet brukes gassformig klor, men virkningen er ganske aggressiv. I stedet brukes natriumhypoklorittløsninger (blekemiddel) eller triklorisocianursyre (ATC) (ATC).
Det foregående viser at det ikke er CL2 Den som utøver desinfeksjonsmessig handling, men Hclo, hypoklorittsyre, som produserer radikaler eller · som ødelegger mikroorganismer.
Blekemiddel
Svært lik sin desinfeksjonsmessige handling, bleker klor også materialene fordi fargene som er ansvarlige for HCLO. Dermed er de kloroniserte løsningene ideelle for å fjerne flekkene fra hvite plagg, eller for å bleke papirmasse.
Polyvinylklorid
Den viktigste klorerte forbindelsen av alle, som omtrent 19% av den gjenværende produksjonen av gassformig klor er tildelt, er vinylpolyklorid (PVC). Denne plasten har flere bruksområder. Med det lages vannrør, Windows -rammer, vegger av vegger og gulv, elektriske ledninger, intravenøse poser, strøk osv.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Klor. Hentet fra: i.Wikipedia.org
- Laura h. et al. (2018). Struktur av fast klor ved 1.45 gpazeitschrift für kristallgraphie. Krystallinske materialer, bind 234, utgave 4, side 277-280, ISSN (online) 2196-7105, ISSN (Print) 2194-4946, doi: doi.org/10.1515/ZKRI-2018-2145
- Nasjonalt senter for bioteknologiinformasjon. (2019). Klor. PubChem -database. CID = 24526. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Marques Miguel. (s.F.). Klor. Gjenopprettet fra: Nautilus.Fis.Uc.Pt
- American Chemistry Council. (2019). Klorkjemi: Introduksjon til klor. Gjenopprettet fra: klor.Americachemistry.com
- Fong-Yan Ma. (s.F.). Etsende effekter av klorider på metaller. Department of Marine Engineering, Ntou Republic of China (Taiwan).
- New York State. (2019). Fakta om klor. Gjenopprettet fra: helse.Ny.Gov
- Dr. Doug Stewart. (2019). Klorelementfakta. Chemicool. Gjenopprettet fra: Chemicool.com

