Klorbenzen (C6H5CL)
- 2218
- 518
- Prof. Theodor Gran
Hva er klorbenzen?
Han Klorbenzen Det er en aromatisk forbindelse av kjemisk formel C6H5CL, spesielt en aromatisk halogenid. Ved romtemperatur er det en fargeløs, brennbar væske, som ofte brukes som et løsningsmiddel og elendig. I tillegg fungerer det som råstoff for produksjon av mange veldig nyttige kjemiske forbindelser.
I forrige århundre fungerte det som grunnlag for syntesen av DDT -insektmidlet, veldig nyttig ved utryddelse av sykdommer som malaria. Imidlertid var det i 1970 bruken av sin høye toksisitet for mennesker. Klorbenzenmolekylet er polært på grunn av større elektronegativitet av klor i forhold til karbonatomet som det binder.
Dette gir en konsekvens av at klor har en moderat tetthet av negativ belastning Δ- med hensyn til karbon og resten av den aromatiske ringen. På samme måte er klorbenzen praktisk talt uoppløselig i vann, men er oppløselig i væsker av aromatisk kjemisk natur, for eksempel: kloroform, benzen, aceton, etc.
I tillegg, Rhodococus phenolicus Det er en bakteriell art som er i stand til å nedbryte klorbenzen som den eneste kilden til karbon.
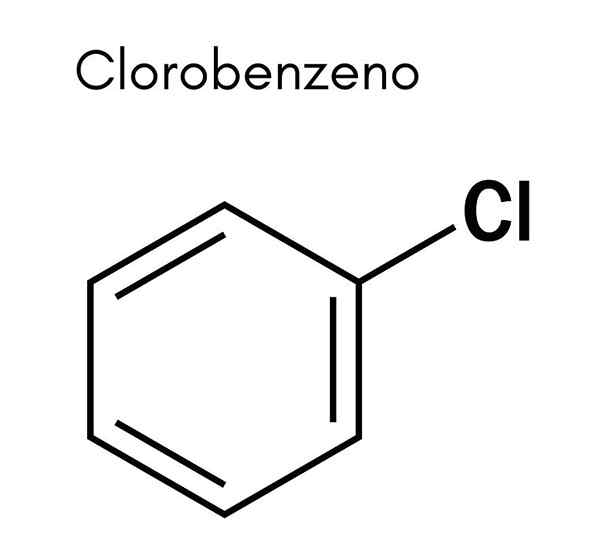
Kjemisk struktur

I det overordnede bildet illustreres strukturen til klorbenzen. De svarte karbonfærer utgjør den aromatiske ringen, mens de hvite og grønne sfærer hydrogen- og kloratomer, tilsvarende.
I motsetning til benzenmolekylet, presenterer klorbenzen et dipolmoment. Dette er fordi CL -atom er mer elektronegativ enn resten av karbonatomer med SP -hybridisering2.
Av denne grunn er det ingen ensartet fordeling av elektronisk tetthet i ringen, men de fleste går til atomet i CL.
Kan tjene deg: putrescina: struktur, egenskaper, syntese, brukI følge denne forklaringen, med et elektronisk tetthetskart, kan det bekreftes at selv om det er svakt, er det en Δ-rik region i elektroner.
Følgelig interagerer klorbenzenmolekyler med hverandre gjennom dipol-dipolo-krefter. De er imidlertid ikke sterke nok til at denne forbindelsen eksisterer i fast fase ved romtemperatur; Av denne grunn er det en væske (men med et kokepunkt større enn benzen).
Kjemiske egenskaper til klorbenzen
Lukt
Lukten er myk, ikke ubehagelig og lik mandel.
Molekylær vekt
112,556 g/mol.
Kokepunkt
131,6 ºC (270 ºF) ved 760 mmHg trykk.
Smeltepunkt
-45,2 ºC (-49 ºF)
Flash Point
27 ºC (82 ºF)
Vannløselighet
499 mg/l a 25 ºC.
Løselighet i organiske forbindelser
Det er blandbar med etanol og etyleter. Det er veldig løselig i benzen, karbondetraklorid, kloroform og karbondisulfid.
Tetthet
1.1058 g/cm3 ved 20 ºC (1,11 g/cm3 ved 68 ºF). Det er en væske som er litt tettere enn vann.
Damptetthet
3.88 med luftforhold. 3.88 (luft = 1).
Damptrykk
8,8 mmHg ved 68 ºF; 11,8 mmHg ved 77 ºF; 120 mmHg ved 25 ºC.
Selvretning
593 ºC (1.099 ºC)
Goo
0,806 MPOISE ved 20 ° C.
Korrosivitet
Angrip noen typer plast, gummi og noen typer fôr.
Forbrenningsvarme
-3.100 kJ/mol ved 25 ºC.
Fordampningsvarme
40,97 kJ/mol ved 25 ºC.
Overflatespenning
33,5 dynas/cm ved 20 ºC.
Ioniseringspotensial
9.07 EV.
Lukt terskel
Luftgjenkjenning 2,1.10-1 ppm. Lav lukt: 0,98 mg/cm3; Høy lukt: 280 mg/cm3.
Kan tjene deg: terbio: struktur, egenskaper, bruk, innhentingEksperimentelt frysepunkt
-45,55 ° C (-50 ºF).
Stabilitet
Det er uforenlig med oksidasjonsmidler.
Syntese
I bransjen brukes metoden som ble introdusert i 1851, der klorgass føres (CL2) gjennom benzenvæske ved en temperatur på 240 ºC i nærvær av jernklorid (FECL3), som fungerer som en katalysator.
C6H6 => C6H5Cl
Klorbenzen er også fremstilt fra anilin i Sandmayers reaksjon. Anilin danner benzezoniumklorid i nærvær av natriumnitritt; og benzezoniumklorid danner benzenklorid i nærvær av kobberklorid.
Applikasjoner/bruk av klorbenzen
Organisk bruk
- Det brukes som et løsningsmiddel, ulykke middel og fungerer som råstoff for utdyping av mange forbindelser med stor nytteverdi. Klorbenzen ble brukt i syntesen av DDT -insektmidlet, for tiden ved misbruk for dets toksisitet for mennesket.
- Selv om klorbenzen i mindre grad brukes i syntesen av fenol, en forbindelse som har soppdrepende, bakteriedrepende, insektmiddel, antiseptisk virkning og brukes også i produksjonen av agrokjemikalier, så vel som i prosessen med å produsere acetisalicycile acid.
- Griper inn i produksjonen av diisocianate, en taleagent for bildeler.
- Det tjener til å oppnå p-nitrochlorobenzen og 2,4 dinitroclorobenzen.
- Det brukes i syntesen av trifenylfosfin, tiophenol og fenylsylanforbindelser.
- Trynylphosphine brukes i syntesen av organiske forbindelser; Tiofenol er et plantevernmidler og farmasøytisk formidler. I stedet brukes fenylsilano i silikonindustrien.
- Det er en del av råstoffet for fremstilling av difenyloksydet, som brukes som et varmeoverføringsmiddel, i kontroll av planter sykdommer og i fremstilling av andre kjemikalier.
- P-nitroklorbenzen oppnådd fra klorbenzen er en forbindelse som brukes som mellomledd i fremstilling av fargestoffer, pigmenter, farmasøytiske produkter (paracetamol) og i gummikjemi.
Bruker for organiske løsningsmidler syntese
Klorbenzen brukes også som råstoff for utdyping av løsningsmidler brukt i synteseaksjonene av organiske forbindelser, så som metylendifenifenildiisocianato (MDI) og uretan.
MDI griper inn i syntesen av polyuretanen, som oppfyller mange funksjoner i utdyping av produkter for konstruksjon, kjøleskap og frysere, møbler til senger, sko, biler, belegg og lim og andre applikasjoner.
På samme måte er Uretano råstoff for utdyping av adjuvansforbindelser av landbruk, malerier, blekk og løsemiddelbrukere for elektronikk i elektronikk.
Medisinsk bruk
- 2.4 Dinitroclorobenzen har blitt brukt i dermatologi i behandlingen av alopecia areata. Det har også blitt brukt i studier av allergi og immunologi av dermatitt, vitiligo og i prognosen for evolusjon hos pasienter med ondartet melanom, kjønnskondylomer og med vulgære vorter.
- Har hatt terapeutisk bruk hos pasienter med HIV. På den annen side har han blitt tilskrevet immunmodulatorfunksjoner, et aspekt som er gjenstand for diskusjon.

