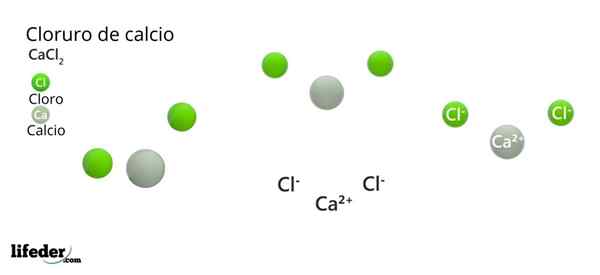
Kalsiumklorid (CaCl2)
- 4457
- 930
- Mathias Aas
Vi forklarer hva kalsiumklorid, dets struktur, fysiske og kjemiske egenskaper, hvordan det syntetiseres og dens anvendelser er
Hva er kalsiumklorid?
Han kalsiumklorid (Cacl2) Det er et uorganisk salt sammensatt av kalsium, alkalisk metall og halogenklor. I den forbindelsen er det flere elektrostatiske interaksjoner som definerer det ytre utseendet til krystaller og resten av dens fysiske egenskaper.
Det er også ledsaget av vannmolekyler, og danner Cocl General Formula Hydrates2· XH2Eller, med x = 0, 1, 2, 4 og 6. Når x = 0, mangler saltet vann og er anhydrid, som indikert av dens kjemiske formel nevnt ovenfor.
I det overlegne bildet er noen faste deler av CACL illustrert2. I forhold med liten luftfuktighet er det mulig.
Formel
Den kjemiske formelen er CACL2: Uttrykker det for hver ca ion2+ Det er to CL -ioner- som nøytraliserer den positive belastningen. Kalsiummetallet av gruppe 2 av det periodiske bordet (SR. Scholambara)- gir sine to elektroner til hvert kloratom, gruppeelement 17.
Kalsiumkloridstruktur
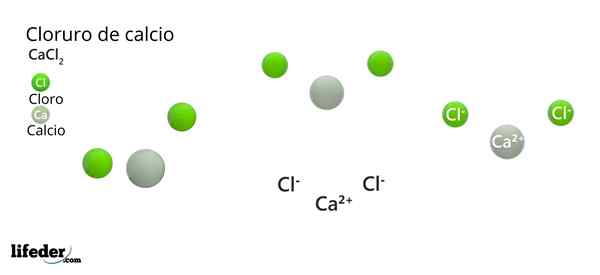
I det overlegne bildet er CACL -strukturen illustrert2 Anhydrid. Grønne kuler tilsvarer CL -ioner-, Mens hvite til ionene Ca2+. Disse kulene er festet i en parallellpiped, som ikke er noe mer enn den enhetlige ortorrombiske cellen til krystallene.
Strukturen kan gi den falske ideen om at kalsium dominerer; Imidlertid, hvis flere repetisjoner av enhetscellen er reprodusert, ville den største overflod av de grønne kulene være klare: CL -ionene-.
På den annen side CA -ioner2+ De har mindre ioniske radioer enn CL -ioner-. Dette er fordi når de mister elektroner, atomene i atomene utøver større attraktiv kraft på de ytre elektroniske lagene, noe som reduserer den ioniske radius.
I tilfelle av CL-, Dette har et ekstra elektron som ikke kan tiltrekkes av samme kraft, og dermed øke sin ioniske radius.
Kan tjene deg: vandige løsningerMolekylær geometri og vandige kalsiumkomplekser
I sentrum av parallellpiped CA2+ Det er omgitt av seks CL-. Fire av disse ligger i et firkantet fly, og de to andre ligger vinkelrett (de mest avsidesliggende grønne kulene i den hvite sfæren).
Som et resultat av arrangementet av disse ionene, rundt CA2+ En octaedro er "våpen", og tildeler dermed en oktaedral molekylær geometri.
Med tanke på hvordan grønne kuler er ordnet, kan et vannmolekyl erstatte en av disse, som oppstår med hjerneslaget2· H2Eller muligens i det firkantede flyet. Dette faktum endrer den krystallinske strukturen, og når vannet erstatter de grønne kulene, endres ionarrangementet mer.
Når alle CL -ioner- De erstattes av vannmolekyler, kaklhydratet dannes2· 6H2ENTEN. På dette tidspunktet er oktaedronen "vandig", og molekylene er nå i stand til å samhandle mellom dem ved hydrogenbroer (CA2+ Oh-h-oh2).
Fortløpende kan kalsium akseptere enda flere vannmolekyler uten å endre den etablerte proporsjonen. Dette betyr at CACL2· 6H2Eller kan ta i bruk andre komplekse strukturer, til det punktet å vurdere krystallinske polymerer av kalsium og vann.
Imidlertid er disse strukturene mindre stabile enn de som er reist av elektrostatiske interaksjoner (CA2+ og cl-) fra anhydridsalt.
Bruker/applikasjoner av kalsiumklorid
De viktigste anvendelsene av kalsiumklorid er:
- Unngå vannfrysing om vinteren. Kalsiumklorid genererer veldig varme når det oppløses, og deretter øker temperaturen, oppstår isfusjon. Av denne grunn brukes det til å redusere risikoen for sirkulasjon av mennesker og kjøretøyer under den kalde stasjonen.
- Hjelp med å kontrollere støv på uspalte veier.
- Akselerere tørkehastigheten til betong en gang strømmet.
- Cachl -væsker2 Effektiviteten av boring for gassutvinning fra underjordiske avsetninger øker, så vel som olje.
- Bassenger legges til for å redusere erosjonen som lides av betongen på veggene. Sedimenterte kalsium oppfyller denne funksjonen.
- Fordi det er et hygroskopisk salt, kan kalsiumklorid brukes som et dissektiv, å kunne senke fuktigheten i den omkringliggende luften og derfor fra stoffer i kontakt med den luften.
- Det brukes som konserveringsmiddel i noen matvarer, så vel som tilsetningsstoff i flere, for eksempel energidrikker som brukes av idrettsutøvere, oster, øl osv.
- I medisinsk praksis har det også nytteverdi i behandlingen av depresjon forårsaket av en overdose av magnesiumsulfat, så vel som i blyforgiftning.
Syntese av kalsiumklorid
De naturlige kildene til denne forbindelsen er Salmueras hentet fra havene eller innsjøene.
Imidlertid kommer hovedkilden fra solvayprosessen, der kalksteinen (Caco3) lider en serie transformasjoner til de er avledet i kalsiumklorid med ved hjelp av kalsium:
2NaCl (aq) + Caco3(S) Na2Co3(S) + CACL2(AC)
Produktet av interesse for denne prosessen er faktisk natriumkarbonat, NA2Co3.
Egenskaper til kalsiumklorid
Fysiske egenskaper og avdelinger
Det er et hvitt, toalett og hygroskopisk fast stoff. Denne tendensen til å absorbere fuktighetens fuktighet skyldes grunniteten til CA -ioner2+.
Grunnleggende av hva slags: av Lewis eller Bronsted? Lewis, fordi den positive arten er i stand til å akseptere elektroner. Disse elektronene blir for eksempel gitt av oksygenatomer med vannmolekyler.
Den faste absorberer fuktighet til graden av oppløsning i samme vann som våter krystaller. Denne eiendommen er kjent som avdelingercencia.
Dens tetthet er 2,15 g/ml. Når den inkorporerer vann i strukturen, er krystallen "utvidet", øker volumet og følgelig reduserer tettheten. Bare CACL2· H2O Bryt med denne trenden, som viser større tetthet (2,24 g/ml).
Molekylvekten av anhydrid salt er omtrent 111 g/mol, og for hvert vannmolekyl øker denne vekten 18 enheter.
Løselighet
Cacl2 Det er veldig løselig i vann og i noen polare løsningsmidler, for eksempel etanol, eddiksyre, metanol og andre alkoholer.
Varmevarme
Når prosessen er oppløst i vann, er den eksoterm og oppvarmet derfor løsningen og omgivelsene.
Kan tjene deg: hvor kommer plast fra? Historie og typerDette er fordi det vandige komplekset bedre stabiliserer CA -ionene2+ i løsning at elektrostatiske interaksjoner med CL -ioner-. Ettersom produktet er mer stabilt, frigjør den faste energien i form av varme.
Elektrolytisk nedbrytning
Cacl2 smeltet kan utsettes for elektrolyse, fysisk prosess som består i separasjonen av en forbindelse i dens elementer fra virkningen av en elektrisk strøm. Når det gjelder dette saltet, er produktene metallisk kalsium og gassformig klor:
Cacl2(l) → Ca (er) + CL2(g)
Ionene c2+ De reduseres i katoden, mens CL -ioner- De oksideres av anoden.
Referanser
- Wikipedia. (2018). Kalsiumklorid. Innhentet fra.Wikipedia.org
- Shiver & Atkins. (2008). Uorganisk kjemi. I gruppe 2 -elementer. (Fjerde utgave., p. 278). Mc Graw Hill.
- Pubchem. (2018). Kalsiumklorid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Oxychem. Kalsiumklorid: En guide til fysiske egenskaper. Oxy kom seg.com
- Carole Ann. Vanlig bruk av kalsiumklorid. Hunker kom seg.com