Jernklorid (III) struktur, egenskaper, innhenting, bruk
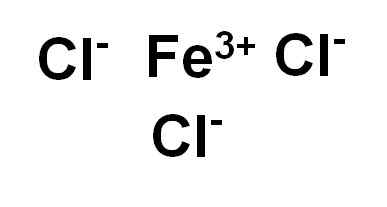
- 2247
- 265
- Theodor Anders Hopland
Han Jernklorid (III) Det er en uorganisk forbindelse dannet av jernet (tro) og klorelementer (CL). Den kjemiske formelen er fecl3. Det er et krystallinsk fast stoff hvis farge kan være fra oransje til svartbrun.
Fecl3 Det blir lett oppløst i vanndannende sure vandige oppløsninger der ved å øke pH, noe som gjør dem mer alkalisk.
 Jernklorid (III) eller jernklorid Fecl3 fast. Гор оин/cc by-sa (https: // creativecommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
Jernklorid (III) eller jernklorid Fecl3 fast. Гор оин/cc by-sa (https: // creativecommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. Jernklorid (III) brukes til å sedimentere partiklene som forurenser kommunalt eller industrielt avløpsvann. Det sies at det lar deg fjerne noen parasitter og tjene til å stoppe blodtap fra dyr hos dyr og for helbredelse av disse.
Det tjener til å trekke ut kobber (ii) av kobbersulfidmineraler. Det brukes også i forskjellige kjemiske reaksjoner og analyse av biologiske og kjemiske laboratorier. For eksempel tjener det til å oppdage forbindelser som fenoler i oljer utvunnet fra planter. Det brukes i elektroniske kretsløp, i læretanneren og i fotografering.
For å være fecl3 En syreforbindelse er etsende for hud- og slimhembraner. Støvet fra denne forbindelsen må unngås. Det skal ikke kastes til miljøet.
[TOC]
Struktur
Jernklorid (III) eller jernklorid Fecl3 Det er en ionisk forbindelse og dannes av en jernholdig tro3+ og tre ioner klorid cl-. Jern er i sin oksidasjonstilstand på +3 og hver klor har Valencia -1.
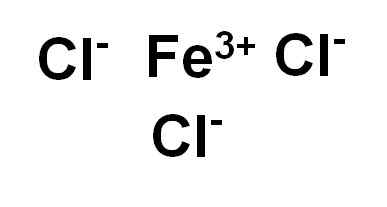 Jernklorid (III) eller jernklorid. Forfatter: Marilú Stea.
Jernklorid (III) eller jernklorid. Forfatter: Marilú Stea. Nomenklatur
- Jernklorid (III)
- Jernklorid
- Jerntriklorid
- Jernmuriature
Egenskaper
Fysisk tilstand
Krystallinsk fast oransje til svartbrun.
 Jernklorid fecl3 vannfri (uten vann). Leiem/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
Jernklorid fecl3 vannfri (uten vann). Leiem/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. Molekylær vekt
Anhidro Fecl3 = 162,2 g/mol
Smeltepunkt
Anhidro Fecl3 = 304 ºC
Hexahydrat Fecl3 •6H2O = 37 ° C
Kokepunkt
Anhidro Fecl3 = Omtrent 316 ºC
Hexahydrat Fecl3 •6H2O = 280-285 ° C
Tetthet
Anhidro Fecl3 = 2,90 g/cm3 ved 25 ° C
Løselighet
Veldig løselig i vann: 74,4 g/100 g vann ved 0 ° C; 535,7 g/100 g vann ved 100 ° C. Veldig løselig i aceton, etanol, eter og metanol. Svakt løselig i ikke -polare løsningsmidler som benzen og heksan.
Kan tjene deg: bor: historie, egenskaper, struktur, brukPh
De vandige oppløsningene er veldig sure. En løsning på 0,1 mol Fecl3 per liter vann har en pH på 2,0.
Kjemiske egenskaper
Når FADL oppløses i vann3 Det er hydrolysert; det vil si at det skiller seg i sine trosioner3+ og 3 cl-. Tro3+ danne heksaacuohierroion [tro (h2ENTEN)6]3+ Men dette er kombinert med OH -ioner- av vannet som danner blandede arter og frigjør protoner h+.
Av denne grunn er løsningene deres sure. Hvis pH øker, danner disse artene en gel og til slutt dannes et bunnfall eller faststoff av hydrert jernoksydtro2ENTEN3 •NH2ENTEN.
Jernkloridkrystaller (III) er hygroskopiske, det vil si at de absorberer vann fra miljøet. Når det er vått er det etsende for aluminium og mange metaller.
 FECL -løsninger3 De kan være veldig sure og etsende, fordi de inneholder HCl. Kanesskong/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
FECL -løsninger3 De kan være veldig sure og etsende, fordi de inneholder HCl. Kanesskong/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. Fecl vandige oppløsninger3 De er veldig sure og etsende for de fleste metaller. De har en svak lukt av HCl -saltsyre. Når FECL varmes opp til dens nedbrytning3 avgir meget giftige HCl -gasser.
Å skaffe
Jernklorid (III) produseres ved direkte klorering av jern ved å reagere tørr klor (CL2) Med jernskrap (tro) ved 500-700 ° C.
Reaksjonen utføres i en syre -resistent reaktor. Det første trinnet er å smelte ved 600 ° C en blanding av jernklorid (III) (FECL3) og kaliumklorid (KCl).
 Fecl3 Det må fremstilles i containere som er veldig motstandsdyktig mot syrer som rustfritt stål. Forfatter: Johannes Plenio. Kilde: Pixabay.
Fecl3 Det må fremstilles i containere som er veldig motstandsdyktig mot syrer som rustfritt stål. Forfatter: Johannes Plenio. Kilde: Pixabay. Deretter blir jernskroppen (tro) oppløst i den smeltede blandingen der jern reagerer med FECL3 Og det blir jernholdig klorid (fecl2).
Fe + 2 Fecl3 → 3 Fecl2
Så fecl2 reagerer med klor CL2 danner fecl3 som sublimater (passerer fra den solide tilstanden til gassen direkte) og blir samlet inn i spesielle kondensasjonskamre.
2 Fecl2 + Cl2 → 2 Fecl3
Du kan også reagere jernholdig feso sulfat4 med klor cl2.
Hexahydrat Fecl3 •6H2O Det kan oppnås ved å fordampe en vandig løsning av trosioner3+ og cl- I et dampbad.
Kan tjene deg: kvartære forbindelser: egenskaper, trening, eksemplerTilstedeværelse i naturen
Ferrisk klorid eller jernklorid (III) finnes i form i form av Mo -mineralmineralet, som finnes i lavaen til aktive vulkanfumaroler. Blant vulkanene der du kan finne er Mount Vesubio.
 Fecl3 Det er en del av malmosmalmen som er i aktive vulkaner. Forfatter: Skeze. Kilde: Pixabay.
Fecl3 Det er en del av malmosmalmen som er i aktive vulkaner. Forfatter: Skeze. Kilde: Pixabay. applikasjoner
I avløpsbehandling
Jernklorid brukes til å behandle kommunalt eller industrielt avløpsvann gjennom kjemisk sedimentasjon.
Det fungerer som en koaguleringsmiddel som favoriserer foreningen av flere partikler med hverandre, på denne måten dannes konglomerater eller større partikler som har en tendens til å flokkulært eller sediment (senke sin egen vekt til bunnen av vannet som blir behandlet).
 Fecl3 Det brukes til å skille uønskede materialer fra vannet som kastes av lokalsamfunn eller bransjer. Forfatter: 后园 卓. Kilde: Pixabay.
Fecl3 Det brukes til å skille uønskede materialer fra vannet som kastes av lokalsamfunn eller bransjer. Forfatter: 后园 卓. Kilde: Pixabay. På denne måten er separasjonen av vannfaststoffer foretrukket, og dette er fritt for uønskede materialer.
Denne typen behandlinger kan lette fjerning av parasitter, for eksempel protozoer, som er mikroorganismer dannet av en enkelt celle, for eksempel amibas, som forårsaker sykdom.
Av denne grunn er Fecl3 Det brukes også til å rense vann.
I veterinærhelingsprosedyrer
Jernklorid (III) brukes til å kurere dyreskader.
Det fungerer som en lokal snerpende (du kan trekke tilbake vev og fungere som anti -inflammatorisk og helbredelse) og hemostatisk (det stopper blødning eller blodtap).
Det brukes i pulver for å stoppe blodtap eller når hestene er blitt kuttet til storfe. Det brukes også i en løsning for å stoppe blødning når klør kuttes eller vorter elimineres.
 Fecl3 Det brukes i pulver som brukes på kyrne kutter horn og unngå infeksjoner. Forfatter: Jaclou DL. Kilde: Pixabay.
Fecl3 Det brukes i pulver som brukes på kyrne kutter horn og unngå infeksjoner. Forfatter: Jaclou DL. Kilde: Pixabay. Det brukes også til å behandle faryngitt (farynx betennelse) eller stomatitt (betennelse i oral slimhinne) og for å øke blodhemoglobin hos noen fugler.
I metallekstraksjon
Jernklorid (III) eller jernklorid Fecl3 Det brukes til å trekke ut kobber (ii) av kobbermalm som inneholder sulfider av nevnte metall.
Kan tjene deg: hydroksiderDet er en oksidativ metode som er tilstrekkelig for å unngå frigjøring av giftig gass svoveldioksid (så2), fordi i stedet for dette er generert svovel (er). Løsninger med høye FECL -konsentrasjoner produseres2, FECL3, Cucl2 og andre metallklorider.
4 FECL3 + Cu2S ⇔ 4 FECL2 + 2 Cucl2 + S ↓
Som et reagens av kjemiske og biologiske laboratorier
Blant mange av kjemienes bruksområder tjener til å indikere tilstedeværelsen av den fenoliske gruppen (det vil si gruppe -OH festet til en benzenring).
Forbindelsen er oppløst for å bli analysert i etanol og noen få dråper FECL -løsning tilsettes3. Når forbindelsen har en gruppe -OH festet til en benzenring (det vil si at det er en fenol) dannes en blåaktig grønn farge.
Denne testen gjør det mulig å analysere tilstedeværelsen av fenoler i planterekstrakter.
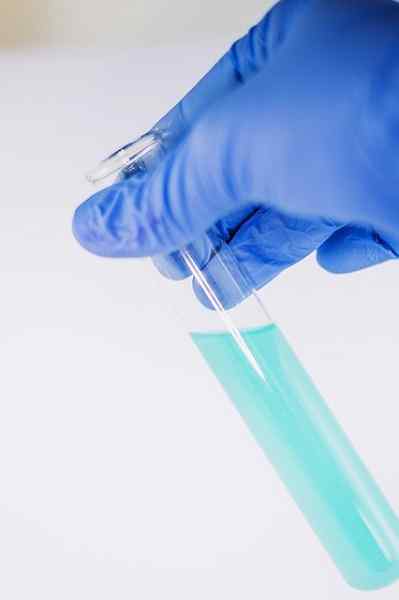 Fecl3 I nærvær av fenoler gir det en blåaktig grønn farge. Forfatter: Ewa Urban. Kilde: Pixabay.
Fecl3 I nærvær av fenoler gir det en blåaktig grønn farge. Forfatter: Ewa Urban. Kilde: Pixabay. Det brukes også i tester for å bestemme antioksidantaktiviteten til visse oljer utvunnet fra grønnsaker.
En annen av anvendelsene er at den gjør det mulig å fremstille andre kjemiske forbindelser. Det kan også fungere som et oksiderende, kloreringsmiddel (gi klor) og kondensator (for å bli med i to eller flere molekyler med hverandre).
Det fungerer også som katalysator eller akselerator for organiske kjemiske reaksjoner.
I flere applikasjoner
Jernklorid brukes i trykte elektroniske kretsløp. Ved å fargelegge de forskjellige hydratiserte former fungerer den som et pigment og brukes i skinnbruneren.
 Fecl3 Det brukes i lærbruning. Forfatter: Pexels. Kilde: Pixabay.
Fecl3 Det brukes i lærbruning. Forfatter: Pexels. Kilde: Pixabay. Det er desinfeksjonsmiddel. Det brukes til å behandle hudlidelser og brukes også i fotografering.
Risiko
FECL -pulver3 Det er irriterende for øyne, nese og munn. Hvis innånding kan forårsake hoste eller pustevansker. Det er en etsende forbindelse, så langvarig kontakt med huden og med øynene eller slimhinnene kan forårsake rødhet og forbrenning.
Det er ikke brannfarlig, men når den er oppvarmet ved høye temperaturer produserer HCl -hydrogenkloridgass, som er giftig og veldig etsende.
Fecl3 Det er skadelig for vannlevende og landorganismer. Hvis det ved en tilfeldighet blir kastet til miljøet, må dets surhet med grunnleggende forbindelser nøytraliseres.
Referanser
- ELLER.S. National Library of Medicine. (2019). Jernklorid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Kirk-Ohmer (1994). Encyclopedia of Chemical Technology. Volum 19. Fjerde utgave. John Wiley & Sons.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte utgave. Volum A22. VCH Verlagsgellschaft MBH.
- Ngameni, f. et al. (2013). Flavonoider og relaterte forbindelser fra medisinplanter i Afrika. Karakterisering av flavonoider i planteekstrakter. Jernklorid test. I medisinsk planteforskning i Afrika. Gjenopprettet fra Scientedirect.com.
- Agyare, c. et al. (2017). PetroseLinum Crispum: En anmeldelse. Antioksidantaktivitet. I medisinske sparter og grønnsaker fra Afrika. Gjenopprettet fra Scientedirect.com.
- Stott, r. (2003). Skjebne og oppførsel av parasitter i renseanlegg for avløpsvann. Kjemisk assistert sedimentering. I Handbook of Water and Wastewater Microbiology. Gjenopprettet fra Scientedirect.com.
- Tasker, s.TIL. et al. (2003). Anvendelser av koordinasjonskjemi. Ekstraksjon av CuIi Fra kloridløsninger. I forståelse av koordinasjonskjemi. Gjenopprettet fra Scientedirect.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.

