Mangankloridegenskaper, struktur, bruk, risiko

- 4664
- 149
- Anders Mathisen
Han Manganklorid Det er et uorganisk salt hvis kjemiske formel er MCL2. Den består av Mn -ioner2+ og cl- i et forhold på 1: 2; For hver kation mn2+ Det er to ganger fra CL -anioner-.
Dette saltet kan danne flere hydrater: MNCL2· 2H2Eller, (dihydrat), MCL2· 4H2Eller (tetrahydrat), og MCL2· 6H2Eller (heksahydrat) Den vanligste saltformen er tetrahydrat.
 Rosa mangankloridkrystaller. Kilde: Ondřej Mangl [Public Domain]
Rosa mangankloridkrystaller. Kilde: Ondřej Mangl [Public Domain] De fysiske egenskapene til manganklorid som tetthet, smelting og løselighetspunkt i vann, påvirkes av deres hydreringsgrad. For eksempel er smeltepunktet for anhydraform mye større enn tetrahydratformen.
Fargen på manganklorid er blekrosa (overlegen bilde). Paleness er karakteristisk for overgangsmetallsalter. Manganklorid er en svak Lewis -syre.
Mineralet kjent som escacquita er den naturlige vannfrie formen for manganklorid (II); Som Kempita.
Manganklorid (II) brukes som en legeringsmiddel; Katalysator i kloreringsreaksjoner, etc.
[TOC]
Fysiske egenskaper
Fysisk utseende
- Anhydra Form: rosa kubikkkrystaller.
- Tetrahydratform: Litt delikate rødlige monokliniske krystaller.
Molmasser
- Anhidro: 125.838 g/mol.
- Dihydrared: 161.874 g/mol.
- Tetrahydrat: 197,91 g/mol.
Fusjonspunkter
- Anhidro: 654 ºC.
- Dihydrared: 135 ºC.
- Tetrahydrat: 58 ºC.
Kokepunkt
Anhidra Form: 1.190 ºC.
Tettheter
- Vannfri: 2.977 g/cm3.
- Dihydrared: 2,27 g/cm3.
- Tetrahydrat: 2,01 g/cm3.
Vannløselighet
Anhydra Form: 63,4 g/100 ml ved 0 ºC; 73,9 g/100 ml ved 20 ºC; 88,5 g/100 ml ved 40 ° C; og 123,8 g/100 ml ved 100 ° C.
Løselighet i organiske løsningsmidler
Løselig i pyridin og etanol, uoppløselig i eter.
Nedbrytning
Med mindre det tas med forsiktighetsregler, kan dehydrering av hydratiserte former til vannfri form forårsake hydrolytisk dehydrering, med produksjon av hydrogenklorid og manganoksychlorid.
Ph
En 0,2 m oppløsning av tetrahydrat manganklorid i vandig løsning har en pH på 5,5.
Kan tjene deg: kromatogramStabilitet
Det er stabilt, men følsomt for fuktighet og uforenlig med sterke syrer, reaktive metaller og hydrogenperoksyd.
Mangankloridstruktur
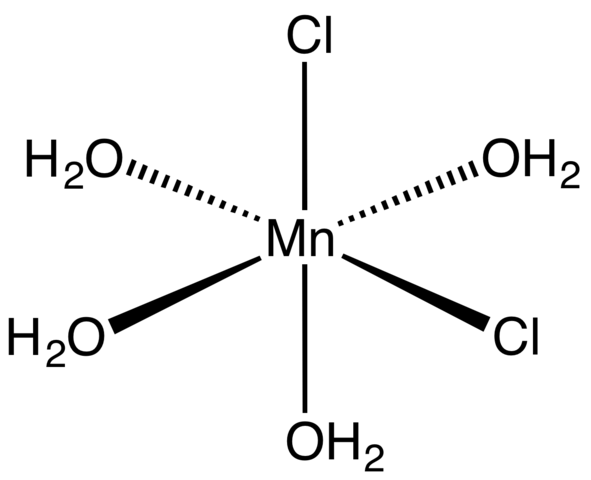 Koordinasjonskompleks for Mncl2 tetrahydrat. Kilde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Koordinasjonskompleks for Mncl2 tetrahydrat. Kilde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Fra og med tetrahydratsalt, rosa og slående krystaller, må det være sammensatt av koordinasjonskomplekser (overlegen bilde). I dem, MN Metallic Center2+ er omgitt av en oktaedron definert av fire H -molekyler2Eller to CL -anioner-.
Legg merke til at CL -ligander- De er i CIS -stillinger; Alle er likeverdige i den rektangulære basen til octaedro, og det spiller ingen rolle om CL er "flyttet"- til noen av de tre andre stillingene. En annen mulig isomer for dette koordinerte molekylet er der begge CL- De er i transposisjoner; det vil si i forskjellige ender (den ene over og den andre nedenfor).
De fire vannmolekylene med sine hydrogenbro. Disse broene er svært retningsbestemte, og legger til de elektrostatiske interaksjonene mellom MN2+ og cl-, De etablerer en ordnet struktur som er karakteristisk for en krystall.
Den rosa fargen på MNCL2· 4H2Eller skyldes de elektroniske overgangene til MN2+ og dens D -konfigurasjon5. På samme måte endrer forstyrrelsene forårsaket av i nærheten av vannmolekylene og kloridene den nødvendige mengden energi som slike elektroner må absorbere5 Å reise høyere energinivå.
Dihydrat
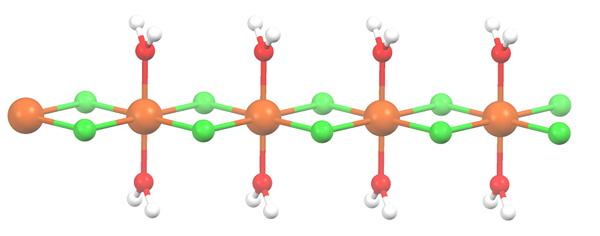 Polymerstruktur for Mncl2 · 2H2O. Kilde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Polymerstruktur for Mncl2 · 2H2O. Kilde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Salt har dehydrert og formelen blir nå MCL2· 2H2ENTEN. Hva som skjer med den fremre oktaedronen? Ingenting, bortsett fra at de to H -molekylene2Eller at de forlot erstattes av to CL-.
Først kan du gi feil inntrykk av at det er fire CL- for hver MN2+; Imidlertid er halvparten av oktaedronen (aksialt) faktisk den repeterende enheten til glasset.
Dermed er det sant at det er en MN2+ koordinert ved to CL- og to vannmolekyler i transposisjoner. Men for at denne enheten skal samhandle med en annen, trenger den to CL -broer, som igjen lar koordinering oktaedronen for manganen fullføres.
Kan tjene deg: Diatomiske elementerI tillegg til CL -broene, samarbeider vannmolekyler også med hydrogenbroene sine, slik at denne MNCL -kjeden2· 2H2Eller ikke avvæpne.
Vannfri
Endelig er magnesiumklorid ferdig med å miste alt vannet som finnes i krystaller; Du har anhydra salt nå, mcl2. Uten vannmolekylene mister krystallene intensiteten i de rosa fargene sine. Oktaedronen, som for hydrater, forblir uendret av selve mangan naturen.
Uten vannmolekyler, MN2+ ender omgitt av en oktaeder bare sammensatt av CL-. Denne koordineringslenken har både kovalent og ionisk karakter; Av denne grunn refererer det vanligvis til strukturen til MNCL2 som en polymerkrystall. I den er det alternative lag med MN og CL.
Nomenklatur
Mangan har mange mulige oksidasjonstilstander. På grunn av det er den tradisjonelle nomenklaturen for MNCL2 Det er ikke avklart.
På den annen side tilsvarer manganklorid det mest kjente navnet, som det vil mangle å legge til '(ii)' slik at det er i henhold til nomenklaturbestanden: manganklorid (ii). Og Asçi, er den systematiske nomenklaturen: mangan -diklorid.
applikasjoner
Laboratorium
Manganklorid fungerer som en katalysator for klorering av organiske forbindelser.
Industri
Manganklorid brukes som råstoff for utdyping av anti -artisantes for bensin; sveisemateriale for ikke -jernholdige metaller; formidler i pigmenter utdyping; Og Linaza oljedrikk.
Det brukes i tekstilindustrien for utskrift og farget; i produksjonen av flere mangansalter, inkludert tricarbonil av metylciclopentadienilmanganeser som ble brukt som mursteinfargestoff; og i produksjonen av tørkede elektriske batterier.
Manganklorid brukes som et legeringsmiddel og tilsettes det smeltede magnesium for å produsere mangan-magnesiumlegeringer; som mellomledd i fremstilling av tørkingsmidler for maling og lakk; og som en komponent av desinfeksjonsmidler.
Kan tjene deg: natriumhydroksid (NaOH): struktur, egenskaper, bruksområder, synteseDet brukes også i magnesiumrensing.
Gjødsel og dyrefôr
Manganklorid brukes som en kilde til mangan, element, som, selv om det ikke.
Det tilfører også fôret av avlsdyr for tilførsel av mangan, en essensiell oligoement for vekst av dyr.
Manganklorid er en kostholdskomponent som leverer mangan, et element som griper inn i mange prosesser som er nødvendige for livet, inkludert: syntese av fettsyrer og kjønnshormoner; assimilering av vitamin E; Bruskproduksjon; etc.
Risiko
Det kan produsere ved kontakt med hud rødhet, irritasjon og langvarig eksponering dermatitt. Manganklorid forårsaker rødhet, smerte og rive.
Ved innånding saltet saltet, sår hals og mangel på pust. På den annen side kan svelging oppstå oppkast, kvalme og diaré.
Overdreven kronisk innånding av dette saltet kan føre til lungebetennelse og påfølgende reaktiv sykdom i luftveiene.
Dets overdreven inntak kan forårsake psykiske lidelser, dehydrering, hypotensjon, lever og nyresvikt, multiorgan -systemsvikt og død.
Nevrotoksisitet er den første manifestasjonen av manganens uønskede virkning, å kunne presentere hodepine, svimmelhet, tap av hukommelse, hyperrefleksi og mild skjelving.
Alvorlig toksisitet manifesteres av symptomer og tegn som ligner på de som er observert ved Parkinsons sykdom.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Mangan (ii) klorid. Hentet fra: i.Wikipedia.org
- Sky Spring Nanomaterials. (2016). Mangankloridpulver. Gjenopprettet fra: Ssnano.com
- Kjemisk bok. (2017). Klorid mangan. Gjenopprettet fra: ChemicalBook.com
- Toksikologi datanettverk. (s.F.). Klorid mangan. Toxnet. Gjenopprettet fra: Toxnet.NLM.NIH.Gov
- Gérard Cahiez. (2001). Mangan (ii) klorid. gjør jeg.org/10.1002/047084289X.RM020
- Nasjonalt senter for bioteknologiinformasjon. (2019). Mangan -diklorid. PubChem -database. CID = 24480. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- WebConsultas Healthcare, S.TIL. (2019). Mineraler: Mangan. Gjenopprettet fra: Web Consultas.com

