Bly kloridegenskaper, struktur, bruk

- 3818
- 94
- Prof. Theodor Gran
Han blyklorid Det er et uorganisk salt hvis kjemiske formel er PBCLn, Hvor n er oksidasjonsnummeret til bly. Når ledelsen er som +2 eller +4, er salt PBCL2 eller PBCL4, henholdsvis. Derfor er det to typer klorider for dette metallet.
Av de to, PBCL2 Det er det viktigste og stabile; Mens PBCL4 er ustabil og av mindre nyttig. Den første er av ionisk natur, der kation Pb2+ genererer elektrostatiske interaksjoner med CL -anionen- å bygge et krystallinsk nettverk; Og det andre er kovalent, med PB-Cl-koblinger med opprinnelse og bly og klor-tetrahedron.
 Utfelt PBCL2 -nåler. Kilde: Rrausch1974 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Utfelt PBCL2 -nåler. Kilde: Rrausch1974 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] En annen forskjell mellom blyklorider er at PBCL2 Det er et fast stoff av hvitt glassformet krystaller (overlegen bilde); Mens PBCL4 Det er en gulaktig olje som kan krystallisere ved -15 ºC. PBCL -inngang2 Det er mer estetisk enn PBCL4.
I tillegg til de nevnte, PBCL2 Det finnes i naturen som det cotunittiske mineralet; Mens PBCL4 Nei, siden det er utsatt for nedbrytninger. Mens fra PBCL4 Du kan få PBO2, av PBCL2 De utleder en uendelig rekke organomethaliske forbindelser.
[TOC]
Egenskaper
Egenskapene til blyklorid avhenger i essensen av oksidasjonsnummeret til bly; Siden endres ikke klor, men gjør måten det samhandler med bly. Derfor må begge forbindelsene tas opp; blyklorid (ii) på den ene siden, og blyklorid (iv) på den andre.
-Blyklorid (ii)
Molmasse
278,10 g/mol.
Fysisk utseende
Hvite fargede krystaller med nålformer.
Tetthet
5,85 g/ml.
Smeltepunkt
501 ºC.
Kokepunkt
950 ºC.
Vannløselighet
10,8 g/l ved 20 ºC. Det er lite oppløselig og vannet må varmes opp slik at en betydelig mengde kan løses opp.
Det kan tjene deg: Nikkelhydroksid (II): Struktur, egenskaper, bruksområder, risikoBrytningsindeks
2.199.
Blyklorid (IV)
Molmasse
349,012 g/mol.
Fysisk utseende
Gulaktig fet væske.
Tetthet
3,2 g/ml.
Smeltepunkt
-15 ºC.
Kokepunkt
50 ºC. Ved høyere temperaturer bryter det ned frigjørende gass klor:
PBCL4(S) => PBCL2(S) + CL2(g)
Faktisk kan denne reaksjonen være veldig eksplosiv, så PBCL lagres4 I svovelsyre ved -80 ºC.
Struktur
-Blyklorid (ii)
Først ble det nevnt at PBCL2 Det er en ionisk forbindelse, så den består av PB -ioner2+ og cl- som bygger en krystall der et PB -forhold er etablert: CL lik 1: 2; Det vil si at det er dobbelt så bra som klesbedrifter- Hvilke kationer pb2+.
Resultatet er at ortorrombiske krystaller dannes hvis ioner kan representeres med en kuler og bar -modell som i det nedre bildet.
 Cotunite struktur. Kilde: Benjah-BMM27 [Public Domain].
Cotunite struktur. Kilde: Benjah-BMM27 [Public Domain]. Denne strukturen tilsvarer også den for det cotunittiske mineralet. Selv om stolpene brukes til å indikere en retning av den ioniske koblingen, bør den ikke forveksles med en kovalent (eller i det minste rent kovalent) lenke).
I nevnte ortorrombiske krystaller PB2+ (Grilliske sfærer) Det har ni cl- (Grønne sfærer) Å omgir ham, som om han var låst inne i et trekantet prisme. For den intrikate av strukturen, og den lave ioniske tettheten av PB2+, Molekylene er vanskelige å løse glasset; grunn til at det er lite oppløselig i kaldt vann.
Gassfase molekyl
Når verken krystallen eller væsken kan motstå høye temperaturer, begynner ionene å fordampe som PBCL -molekyler2 diskret; Det vil si med CL-Pb-CL kovalente bindinger og en vinkel på 98º, som om det var en boomerang. Det sies da at gassfasen består av disse PBCL -molekylene2 og ikke av ioner båret av luftstrømmer.
Kan tjene deg: elektronegativitetBlyklorid (IV)
I mellomtiden PBCL4 Det er en kovalent forbindelse. Fordi? Fordi kation Pb4+ Den er mindre og har også større ionelasttetthet enn PB2+, som forårsaker større polarisering av den elektroniske skyen til CL-. Resultatet er at i stedet for et samspill mellom den ioniske typen PB4+Cl-, Den pb-cl kovalente lenken dannes.
Med tanke på dette forstås likheten mellom PBCL4 Og for eksempel CCL4; Begge presenteres som tetraedrale individuelle molekyler. Dermed forklares det hvorfor dette blykloridet er en gulaktig olje under normale forhold; Atomene til CL er noen få relatert til hverandre og "glir" når to PBCL -molekyler4 De kommer.
Imidlertid, når temperaturen går ned og molekylene blir tregere, økes sannsynligheten og effekten av øyeblikkelige dipoler (PBCL4 Den er apolar gitt sin symmetri); Og så fryser oljen som gule sekskantede krystaller:
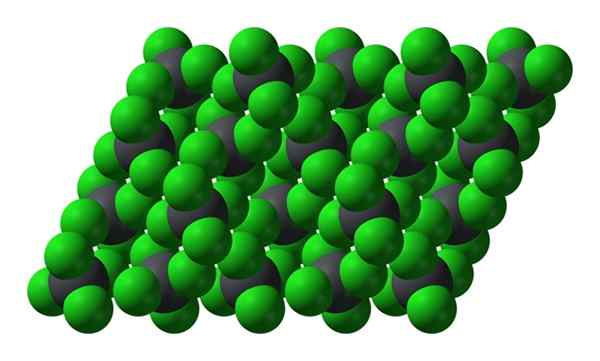 Krystallinsk struktur av PBCL4. Kilde: Benjah-BMM27 [Public Domain]
Krystallinsk struktur av PBCL4. Kilde: Benjah-BMM27 [Public Domain] Merk at hver gråaktig sfære er omgitt av fire grønne kuler. Disse PBCL -molekylene4 "Klemmet" utgjør en ustabil krystall og mottakelig for å nedbryte kraftig.
Nomenklatur
Navnene: Blyklorid (II) og blyklorid (IV) tilsvarer de som er tildelt i henhold til bestandsnomenklaturen. Siden oksidasjonsnummeret +2 er det minste for bly, og +4 den største, kan begge kloridene navngis i henhold til den tradisjonelle nomenklaturen som plumbose klorid (PBCL2), og plúbisk klorid (PBCL4), henholdsvis.
Og til slutt er den systematiske nomenklaturen, som fremhever antallet av hvert atom i forbindelsen. Dermed PBCL2 Det er blydiklorid, og PBCL4 bly tetraklorid.
Det kan tjene deg: kjemisk ugjennomtrengeligapplikasjoner
En praktisk bruk for PBCL er ikke kjent4 I tillegg til å servere PBO -syntese2. Imidlertid PBCL2 Det er mer nyttig, og det er grunnen til at bare noen bruksområder for dette spesifikke blykloridet vil bli listet opp nedenfor:
- På grunn av sin svært selvlysende natur er den bestemt til fotografiske, akustiske, optiske og strålingsdetektorer.
- Ikke absorberende i det infrarøde spektrumområdet, brukes det til fremstilling av glass som overfører denne typen stråling.
- Han har vært en del av det de kaller Aureno -glasset, et attraktivt materiale av iriserende blålige fargelegg som brukes til prydformål.
- Også etter kunsttemaet, når du er nådd, PBCL2· PB (OH)2 skaffer seg intense hvitaktige nyanser, ved hjelp av hvitt blypigment. Imidlertid har bruken blitt motløs på grunn av den høye toksisiteten.
- Smeltet og blandet med bariumtitanat, batio3, stammer fra titanato keramikk av barium og bly BA1 - XPbxOnkel3. Hvis en Pb2+ Gå inn i Batio3, En ba2+ Du må forlate glasset for å tillate inkorporering, og det sies da at en kationutveksling skjer; Det er grunnen til sammensetningen av BA2+ Det uttrykkes som 1-x.
- Og til slutt, fra PBCL2 Flere organometaliske forbindelser av generell formel rumula er syntetisert r4Pb eller r3PB-PBR3.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Bly (ii) Klorid. Hentet fra: i.Wikipedia.org
- Kjemisk formulering. (2019). Blyklorid (IV). Gjenopprettet fra: Quimica -formulering.com
- Clark Jim. (2015). Kloridene i karbon, silisium og bly. Gjenopprettet fra: Chemguide.co.Storbritannia
- Spektrale og optiske ikke -lineære studier på blyklorid (PBCL2) Krystaller. [PDF]. Gjenopprettet fra: Shodhganga.Infibnet.Ac.i
- Nasjonalt senter for bioteknologiinformasjon. (2019). Blyklorid. PubChem -database; CID = 24459. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- « Mangankloridegenskaper, struktur, bruk, risiko
- Konvertering koster hvordan beregnet og eksempler »

