Hva er vektlovene for kjemi? (Eksempler)

- 3585
- 190
- Theodor Anders Hopland
De Brukerlover for kjemi De er de som har vist at massene av stoffene som reagerer ikke gjør det vilkårlig eller tilfeldig; men å opprettholde en konstant matematisk andel av hele tall eller submultipper av dem, der atomene til elementene ikke er opprettet eller ødelagt.
I tidligere tider krevde disse lovene ekstraordinær innsats for resonnement; For selv om det nå virker for tydelig, var ikke engang kjent at atom- eller molekylære masser av elementene eller forbindelsene.
 Kilde: Jeff Keyzer fra Austin, TX, USA [CC BY-SA 2.0 (https: // creativecommons.Org/lisenser/by-SA/2.0)]
Kilde: Jeff Keyzer fra Austin, TX, USA [CC BY-SA 2.0 (https: // creativecommons.Org/lisenser/by-SA/2.0)] Siden det ikke var kjent hvordan nøyaktig en mol av atomer i hvert element var likeverdige, måtte kjemikaliene på det attende og nittende århundre være basert på de reagerende massene. Slik at rudimentære analytiske skalaer (overlegen image) var uatskillelige følgesvenner under hundrevis av eksperimenter som var nødvendige for oppgjøret av vektingslovene.
Det er av denne grunn at når disse lovene om kjemi blir studert, snublet de over massemålinger i hvert øyeblikk. Takket være dette, ekstrapolere resultatene av eksperimentene, ble det oppdaget at kjemiske forbindelser Ren De danner alltid med samme masseandel av sine konstituerende elementer.
[TOC]
Lov om bevaring av masse
Denne loven sier at i en kjemisk reaksjon er den totale massen av reagensene lik den totale massen av produktene; Så lenge systemet som er vurdert er lukket og det ikke er noen utveksling av masse og energi med omgivelsene.
I en kjemisk reaksjon forsvinner ikke stoffer, men blir forvandlet til andre stoffer med lik masse; Derfra den berømte frasen: "Ingenting er skapt, ingenting blir ødelagt, alt blir forvandlet".
Historisk sett ble loven om massekonservering i en kjemisk reaksjon først foreslått i 1756 av Mikhail Lomonsov, som i sin dagbok viste resultatene av eksperimentene hans.
Deretter i 1774 presenterte Antoine Levoisier, en fransk kjemiker, resultatene av eksperimentene hans som tillot å etablere dette; som noen også kaller det Lavoisiers lov.
-Lavoisier eksperimenter
I Lavoisier-tiden (1743-1794) var det teorien om flogisto, hvor kroppene hadde evnen til å betente eller brenne. Lavoisier -eksperimenter tillatt å forkaste denne teorien.
Lavoisier utførte mange forbrenningseksperimenter. Han veide materialene nøye før og etter forbrenningen i en lukket beholder, og fant at det var en tilsynelatende vektøkning.
Men lavoiser, basert på kunnskapen om oksygenens rolle i forbrenning, konkluderte med at vektøkningen i forbrenning skyldtes inkorporering av oksygen i forbrenningsmaterialet. Begrepet metalloksider ble født.
Derfor forble summen av massene av metaller som ble utsatt for forbrenning og oksygen uforanderlig. Denne konklusjonen tillot etablering av massebevaringsloven.
-Balansering av ligninger
Massebevaringsloven etablerte behovet for å balansere kjemiske ligninger, og garanterte at antallet alle elementer som er involvert i en kjemisk reaksjon, så vel som reagenser eller produkter, er nøyaktig det samme.
Dette er et essensielt krav for nøyaktigheten av de støkiometriske beregningene som gjøres.
-Beregninger
Mol vann
Hvor mange mol vann kan oppstå under forbrenningen av 5 mol metan i et overflødig oksygen? Viser også at loven om bevaring av materie er oppfylt.
Ch4 + 2 o2 => Co2 + 2 h2ENTEN
Når jeg observerer den balanserte reaksjonens ligning, konkluderes det med at 1 mol metan produserer 2 mol vann.
Problemet kan løses direkte med en enkel tilnærming, siden vi ikke har 1 mol, men 5 mol CHO4:
Mol vann = 5 mol med cho4· (2 mol h2O / 1 mol av Cho4)
= 10
Hva som vil være ekvivalent med 180 g h2ENTEN. 5 mol eller 220 g CO ble også dannet2, som er lik en total masse på 400 g produkter.
For loven om bevaring av emnet for å reagere 400 g reagenser; intet mer, intet mindre. Av de 400 g, tilsvarer 80 g de 5 molene CHO4 (Multipliserer med dens molekylmasse på 16 g/mol) og 320 g ved 10 mol O2 (Tilsvarende på grunn av molekylmassen på 32 g/mol).
Forbrenning av et magnesiumbånd
En 1,50 g magnesiumbånd brent i en lukket beholder som inneholder 0,80 g oksygen. Etter forbrenning var 0,25 g oksygen i beholderen. a) Hva oksygenmasse reagerte? b) Hvor mye magnesiumoksyd ble dannet?
Kan tjene deg: Hypotonisk løsning: Komponenter, forberedelser, eksemplerOksygenmassen som reagerte oppnås ved en enkel forskjell.
Oksygenmasse konsumert = (initial masse - restmasse) oksygen
= 0,80 g - 0,25 g
= 0,55 g eller2 (til)
I henhold til massekonserveringsloven,
Magnesiumoksydmasse = magnesiummasse +oksygenmasse
= 1,50 g + 0,55 g
= 2,05 g MgO (b)
Lov om bestemte proporsjoner
Joseph Louis Proust (1754-1826), fransk kjemiker, innså at i en kjemisk reaksjon reagerer de kjemiske elementene alltid i faste masseforhold for å danne en forbindelse ren spesifikk; Derfor er sammensetningen konstant, uavhengig av kilde eller opprinnelse, eller hvordan den er syntetisert.
Proust i 1799 uttalte loven om de definerte proporsjonene, som sier at: "Når to eller flere elementer kombineres for å danne en forbindelse, gjør de det i et fast masseforhold". Så dette forholdet er fast og avhenger ikke av strategien som følges for utarbeidelse av forbindelsen.
Denne loven er også kjent som loven om konstant sammensetning, som sier at: "Hver kjemisk forbindelse i renhet inneholder alltid de samme elementene, i en konstant andel av masse".
-Illustrasjon av loven
Jern (tro) reagerer med svovel (er) for å danne jernsulfid (FES), tre situasjoner kan indikeres (1, 2 og 3):
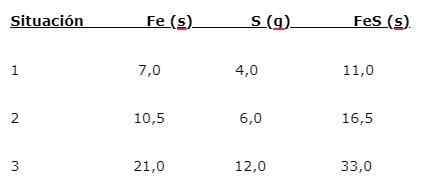
For å finne andelen som elementene er kombinert, er hovedmassen (tro) delt på mindre masse (er). Beregningen gir en andel på 1,75: 1. Denne verdien gjentas under de tre gitt forholdene (1, 2 og 3), hvor den samme andelen oppnås, selv om forskjellige masser brukes.
Det vil si at 1,75 g tro er kombinert med 1,0 g s for å gi 2,75 g FES.
-applikasjoner
Gjennom søknaden denne loven kan du kjenne nøyaktig massene av elementene som må kombineres for å oppnå en ønsket masse av en forbindelse.
På denne måten kan informasjon om resterende masser av noen av elementene som er involvert i en kjemisk reaksjon oppnås, eller hvis det er et begrensende reagens i reaksjonen.
I tillegg gjelder det å kjenne den centesimale sammensetningen av en forbindelse, og basert på sistnevnte kan formelen til en forbindelse etableres.
Centesimal sammensetning av en forbindelse
Karbondioksid (CO2) dannes i følgende reaksjon:
C +O2 => Co2
12 g karbon 32 g oksygen kombineres for å gi 44 g karbondioksid.
Så karbonprosenten er lik
Karbonprosent = (12 g / 44 g) · 100 %
= 27,3 %
Oksygenprosent = (32 g / 44 g) · 100 %
Oksygenprosent = 72,7 %
Ved å bruke uttalelsen om loven om konstant sammensetning, kan det bemerkes at karbondioksid alltid dannes av 27,3 % karbon og 72,7 % oksygen.
-Beregninger
Svoveltrioksid
Ved å reagere i forskjellige containere 4 g og 6 g svovel (er) med oksygen (O), ble de oppnådd henholdsvis 10 g og 15 g svoveltrioksid (SO3).
Hvorfor var slike mengder svoveltrioksid og ikke andre?
Beregn også mengden svovel som er nødvendig for å kombinere med 36 g oksygen og den oppnådde svoveldrioksiddeigen.
Del A)
I den første beholderen blandes 4 g g oksygen for å oppnå 10 g trioksid. Hvis massebevaringsloven blir brukt, kan vi fjerne oksygenmassen som ble kombinert med svovel.
Oksygenmasse = 10 g oksygentrioksid - 4 g svovel.
= 6 g
I container 2 6 g svovel blandes med x g oksygen for å oppnå 15 svoveltrioksid.
Oksygenmasse = 15 g svoveltrioksid - 6 g svovel
= 9 g
Andelene o/s for hver beholder blir deretter beregnet:
Andel o / s i situasjonen 1 = 6 g o / 4 g s
= 1,5 / 1
Andel o / s i situasjonen 2 = 9 g o / 6 g s
= 1,5 / 1
Som er enig i det som reises i loven for de definerte proporsjonene som indikerer at elementene alltid er kombinert i samme andel for å danne en viss forbindelse.
Derfor er verdiene som er oppnådd riktige, og de som tilsvarer anvendelsen av loven.
Del B)
I forrige seksjon ble en verdi på 1,5 / 1 beregnet for andelen O / S.
Kan tjene deg: stater for aggregering av materieg svovel = 36 oksygen · (1 g svovel / 1,5 g oksygen)
= 24 g
g svoveltrioxide = 36 g oksygen + 24 g svovel
= 60 g
Klor og magnesium
Klor og magnesium er kombinert i andelen 2,95 g klor for hver g magnesium. a) Bestem massene av klor og magnesium som er nødvendige for å oppnå 25 g magnesiumklorid. b) Hva er prosentsammensetningen av magnesiumklorid?
Del A)
Basert på 2,95 -verdien for CL -forholdet: MG, kan følgende tilnærming gjøres:
2,95 g CL +1 g Mg => 3,95 g Mgcl2
Deretter:
g av CL = 25 g Mgcl2 · (2,95 g Cl / 3,95 g Mgcl2)
= 18.67
G mg = 25 g mgcl2 · (1 g Mg / 3,95 g Mgcl2)
= 6.33
Deretter kombineres 18,67 g klor med 6,33 g magnesium for å produsere 25 g magnesiumklorid.
Del B)
Den molekylære massen av magnesiumklorid, MGCL beregnes først2:
MGCL molekylvekt2 = 24,3 g/mol + (2 · 35,5 g/mol)
= 95,3 g/mol
Magnesiumprosent = (24,3 g / 95,3 g) x 100 %
= 25,5 %
Klorprosent = (71 g / 95,3 g) x 100 %
= 74,5 %
Lov om flere proporsjoner eller lov i Dalton
Loven ble uttalt i 1803 av den franske kjemikeren og meteorologen John Dalton, basert på hans observasjoner angående reaksjonene fra atmosfæriske gasser.
Loven ble uttalt som følger: "Når elementer kombineres for å gi mer enn den ene forbindelsen, blir en variabel masse av en av dem sammen med en fast masse av den andre, og den første har som et forhold mellom kanoner og utydelige tall".
Også: "Når to elementer kombineres for å forårsake forskjellige forbindelser, gitt en fast mengde av en av dem, er de forskjellige mengdene av det andre elementet som er kombinert med det faste beløpet for å produsere forbindelsene, i forhold til enkle hele tall".
John Dalton laget den første moderne beskrivelsen av atomet som en komponent av de kjemiske elementene, da han påpekte at elementene er dannet av udelelige partikler som kalles atomer.
I tillegg postulerte han at forbindelsene dannes når atomer av forskjellige elementer kombineres med hverandre i proporsjoner av enkle heltall.
Dalton fullførte Prousts forskningsarbeid. Han påpekte eksistensen av to tinnoksider, med prosenter på henholdsvis 88,1% og 78,7% tinn med de tilsvarende prosentene av oksygen, 11,9% og 21,3%.
-Beregninger
Vann og hydrogenperoksyd
Viser at vannforbindelser, h2Eller, og hydrogenperoksyd, h2ENTEN2, De overholder loven om flere proporsjoner.
Atomiske vekter av elementene: h = 1 g/mol og oksygen = 16 g/mol.
Molekylære pesos av forbindelsene: h2O = 18 g/mol og h2ENTEN2 = 34 g/mol.
Hydrogen er elementet med et fast beløp i H2Eller og h2ENTEN2, Så proporsjonene mellom O og H vil bli etablert i begge forbindelser.
O/H -forhold i H2O = (16 g/mol)/(2 g/mol)
= 8/1
O/H -forhold i H2ENTEN2 = (32 g/mol)/(2 g/mol)
= 16/1
Forholdet mellom begge proporsjoner = (16/1)/(8/1)
= 2
Deretter er forholdet mellom OR/H mellom hydrogenperoksyd og vann 2, et heltall og enkelt tall. Det er demonstrert overholdelse av loven om flere proporsjoner.
Nitrogenoksider
Hvilken oksygenmasse kombineres med 3,0 g nitrogen i A) nitrogenoksid, NO og B) nitrogendioksid, NO2. Vis at nei og nei2 De overholder loven om flere proporsjoner.
Nitrogenmasse = 3 g
Atomvekter: nitrogen, 14 g/mol og oksygen, 16 g/mol.
Beregninger
I nei er et atom av N kombinert med 1 atom av O, slik at oksygenmassen som er kombinert med 3 g nitrogen kan beregnes ved følgende tilnærming:
G O = g nitrogen · (PA. O / pa. N)
= 3 g · (16 g/mol/14 g/mol)
= 3,43 g eller
I nei2, Et atom av N er kombinert med 2 atomer av O, så massen av oksygen som er kombinert er:
g oksygen = 3 g · (32 g/mol/14 g/mol)
= 6,86 g eller
Andel o/ n ved nr = 3,43 g o/ 3 g n
= 1.143
Proporsjon eller/n i ingen2 = 6,86 g o / 3 g n
= 2.282
Verdien av forholdet mellom proporsjoner o / n = 2 282 / 1,143
= 2
Deretter er verdien av forholdet mellom proporsjonene eller/n 2, et heltall og enkelt tall. Derfor er loven om flere proporsjoner oppfylt.
Lov om gjensidige proporsjoner
Denne loven formulert av Richter og Carl F. Wenzel separat.
Kan tjene deg: natrium: historie, struktur, egenskaper, risikoer og brukFor eksempel, hvis du har de to forbindelsene AB og CB, observeres det at det vanlige elementet er B.
Richter-Wenzels lov eller gjensidige proporsjoner sier at når du vet hvor mye av en reagerer med B å gi AB, og hvor mye C reagerer med B for å gi CB, kan du beregne massen som det er nødvendig for å reagere med en C-masse til Form Ac.
Og resultatet er at andelen til: C eller A/C må være en multiplum eller submultippel av A/B eller C/B. Imidlertid blir denne loven ikke alltid oppfylt, spesielt når elementene presenterer flere oksidasjonstilstander.
Av alle vektlovene er dette kanskje de mest "abstrakte" eller kompliserte. Men hvis den analyseres fra et matematisk synspunkt, vil det sees som bare består av konvertering og avbestillingsfaktorer.
-Eksempler
Metan
Hvis det er kjent at 12 g karbon reagerer med 32 g oksygen for å danne karbondioksid; og at på den annen side reagerer 2 g hydrogen med 16 g oksygen for å danne vann, så kan masseforholdene C/O og H/eller for CO estimeres2 og h2Eller henholdsvis.
Beregning av C/O og H/eller du har:
C / o = 12g c / 32g eller
= 3/8
H / o = 2g h / 16g eller
= 1/8
Oksygen er det vanlige elementet, og det er ønsket å vite hvor mye karbon som reagerer med hydrogen for å produsere metan; Det vil si at du vil beregne C/H (eller H/C). Deretter er det nødvendig å gjøre en inndeling av de tidligere proporsjonene for å demonstrere om gjensidigheten er oppfylt eller ikke:
C/h = (c/o)/(h/o)
Merk at OS på denne måten blir kansellert og C/H gjenstår:
C/h = (3/8)/(1/8)
= 3
Og 3 er en 3/8 multiplum (3/8 x 8). Dette betyr at 3 g C reagerer med 1 g H for å gi metan. Men for å kunne sammenligne det med CO2, Den multipliseres C/H med 4, som er lik 12; Dette gir 12 g C som reagerer med 4 g H for å danne metan, noe som også er sant.
Magnesiumsulfid
Hvis det er kjent at 24 g magnesium reagerer med 2 g hydrogen for å danne magnesiumhydrid; Og i tillegg reagerer 32 g svovel med 2 g hydrogen for å danne hydrogensulfid, elementet til felles er hydrogen og ønsker å beregne mg/s fra mg/t og h/s.
Deretter beregner du mg/h og h/s separat har du:
Mg / h = 24g mg / 2g h
= 12
H / s = 2g h / 32g s
= 1/16
Imidlertid er det praktisk å bruke S/H for å avbryte H. Derfor er S/H lik 16. Gjort dette, fortsetter vi med å beregne mg/s:
Mg/s = (mg/t)/(s/h)
= (12/16)
= 3/4
Og 3/4 er en submultippel på 12 (3/4 x 16). Mg/s -andelen indikerer at 3 g Mg reagerer med 4 g svovel for å danne magnesiumsulfid. Imidlertid må du multiplisere mg/s med 8 for å kunne sammenligne det med Mg/t. Dermed reagerer 24 g Mg med 32 g svovel for å gi dette metalliske sulfidet.
Aluminiumklorid
Det er kjent at 35,5 g CL reagerer med 1 g H for å danne HCl. Også 27 g Al reagerer med 3 g H for å danne ALH3. Beregn andelen aluminiumklorid og si om en slik forbindelse adlyder Richter-Wenzels lov.
Igjen beregnes Cl/H og AT/H separat:
Cl / h = 35,5g Cl / 1g H
= 35.5
AT/ H = 27g AT/ 3G H
= 9
Nå beregnes den til/CL:
At/cl = (al/h)/(cl/h)
= 9/35.5
≈ 0,250 eller 1/4 (det er faktisk 0,253)
Det vil si 0,250 g Al reagerer med 1 g CL for å danne det tilsvarende saltet. Men igjen, det må multipliseres til/CL med et tall som tillater å sammenligne det (for komfort) med al/t.
Impliser i beregningen
Den multipliseres deretter AT/CL med 108 (0,27/250), og gir 27 g hvorav den reagerer med 108 g CL. Dette skjer ikke nettopp slik. Hvis vi for eksempel tar 0,253 -verdien med Al/CL, og vi multipliserer den med 106,7 (27/0,253), reagerer 27 g Al med 106,7 g CL; Som den nærmer seg mer til virkeligheten (Alcl3, med en PA på 35,5 g/mol for CL).
Her observeres det hvordan Richters lov kan begynne å stagy på grunn av presisjon og misbruk av desimaler.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Blomster, j. Kjemi (2002). Santillana redaksjon.
- Joaquín San Frutos Fernández. (s.F.). Vekt og volumetriske lover. Gjenopprettet fra: Encina.pntic.Mec.er
- Toppr. (s.F.). Laws of Chemical Combination. Gjenopprettet fra: Toppr.com
- Strålende. (2019). Laws of Chemical Combination. Gjenopprettet fra: strålende.org
- Kjemi librettexts. (15. juli 2015). Grunnleggende kjemiske lover. Gjenopprettet fra: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (18. januar 2019). Lov om bevaring av masse. Gjenopprettet fra: Thoughtco.com
- « Erobring av Colombia oppdagelse, stadier, konsekvenser
- 9 arbeidsutganger fra forretningsadministrasjonskarrieren »

